
科目: 来源: 题型:
【题目】利用如图所示装置,甲中盛有100mL 0.1mol/LCuSO4溶液,乙中盛有100mL 0.2mol/L Na2SO4溶液。
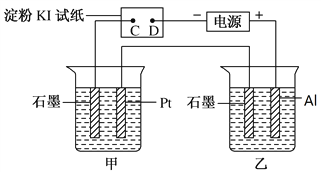
(1)通电一段时间,观察到湿润的淀粉KI试纸的_____(选填“C”或“D”)端变蓝。
(2)装置乙中观察到的现象是_________________________________________。
(3)若电解一段时间后,装置甲、乙中共收集到气体0.168 L(标准状况下),则:
①装置甲中发生反应的离子反应方程式为______________________________。
②若电解前后体积变化忽略不计,则电后装置甲中溶液的c(H+)为________。
(4)若电解一段时间后,装置甲中溶液需加入0.005mol碱式碳酸铜才能恢复原来的浓度和pH,则电解过程中转移的电子数目为__________。
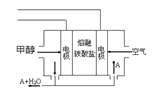
(5)若装置中的电源使用如右图的一种新型燃料电池,以甲醇为燃料,一定比例的Li2CO3和Na2CO3的熔融混合物为电解质,则负极反应式为__________________。
(6)电解一段时间后,拆解装置,将图中甲装置取出后,用导线将石墨和Pt连接构成闭合回路。则此装置中Pt上发生的电极反应式是_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】氧化还原反应与电化学及金属的防护知识密切相关。请回答下列问题:

Ⅰ、依据反应: 2Ag+(aq)+Cu=== Cu2+ (aq) +2Ag设计的原电池如图1所示。则电解质溶液Y是___________ (填化学式),X的电极反应式__________________。若将盐桥换成铜丝,则X电极名称是____________。
Ⅱ、 用图2的装置进实验。
(1)若A为Zn,实验时开关K与a连接,则能模拟钢铁的一种电化学防护方法,名称为______。
(2)若A为石墨,将开关K与b连接,则有关该实验的说法正确的是(填序号)________。
①溶液中Na+向A极移动
②从A极处逸出的气体能使湿润的蓝色石蕊试纸先变红后褪色
③反应一段时间后加适量盐酸可恢复到电解前电解质的浓度
④若标准状况下B极产生2.24 L气体,则电路中转移0.2 mol电子
⑤电子流动方向:电源负极→B→饱和食盐水→A→电源正极
⑥若实验前滴入酚酞,B极区附近溶液先变红
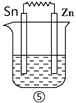
Ⅲ、 如下图所示装置中都盛有0.1 mol/L的NaCl溶液,放置一定时间后,装置中的五块相同锌片,腐蚀速率由快到慢的正确顺序是______________。

查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关说法错误的是
A.医药中常用酒精消毒,是因为酒精能使细菌蛋白质变性
B.聚酯纤维、光导纤维都属于有机高分子材料
C.对废旧电池回收处理是为了防止重金属污染水源和土壤
D.绿色化学的核心是从源头上减少和消除化工生产对环境的污染
查看答案和解析>>
科目: 来源: 题型:
【题目】热化学方程式中的ΔH实际上是热力学中的一个物理量,叫做焓变,其数值和符号与反应物和生成物的总能量有关,也与反应物和生成物的键能有关。
(1)图①是N2(g)和O2(g)反应生成NO(g)过程中的能量变化示意图,则该反应的热化学方程式为______________________;分析图②可知,若0.5 mol CO被氧化,放出Q kJ热量,则Q=________;若该反应是可逆反应,则在相同条件下将0.5 mol CO与1 mol NO2混合充分反应后放出的热量________Q kJ(填“>”“<”或“=”)。

(2)相关反应的热化学方程式如下:
CaSO4(s)+CO(g) ![]() CaO(s)+SO2(g)+CO2(g) ΔH1=+218.4 kJ·mol-1(反应Ⅰ)
CaO(s)+SO2(g)+CO2(g) ΔH1=+218.4 kJ·mol-1(反应Ⅰ)
CaSO4(s)+4CO(g) ![]() CaS(s)+4CO2(g) ΔH2=-175.6 kJ·mol-1(反应Ⅱ)
CaS(s)+4CO2(g) ΔH2=-175.6 kJ·mol-1(反应Ⅱ)
①反应Ⅰ 能够自发进行的反应条件是________________________________。
②假设某温度下,反应 Ⅰ 的速率(v1)大于反应 Ⅱ 的速率(v2),则下列反应过程能量变化示意图正确的是________。


(3)已知:①Fe2O3(s)+3CO(g) === 2Fe(s)+3CO2(g) ΔH=-25 kJ·mol-1,
②3Fe2O3(s)+CO(g) ===2Fe3O4(s)+CO2(g) ΔH=-47 kJ·mol-1,
③Fe3O4(s)+CO(g) ===3FeO(s)+CO2(g) ΔH=+19 kJ·mol-1。
请写出CO还原FeO的热化学方程式:__________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】与链烃相比,苯的化学性质的主要特征是( )
A. 难氧化、难取代、难加成 B. 易氧化、易取代、易加成
C. 难氧化、可加成、易取代 D. 易氧化、易加成、难取代
查看答案和解析>>
科目: 来源: 题型:
【题目】在实验室中,下列除去杂质的方法正确的是
A.溴苯中混有溴,加入KI溶液,振荡,再用汽油萃取
B.硝基苯中混有浓硝酸和浓硫酸,将其倒入到NaOH溶液中,静置,分液
C.乙烷中混有乙烯,通氢气在一定条件下反应,使乙烯转化为乙烷
D.乙烯中混有SO2和CO2,将其先后通入NaOH和KMnO4溶液中洗气
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是( )
A. 如图可表示水分解过程中的能量变化

B. 增大反应物浓度,是增大了活化分子百分数使反应速率增大。
C. 需要加热的反应一定是吸热反应,常温下能发生的反应一定是放热反应
D. 已知:Ⅰ:对于反应:H2(g)+Cl2(s)=2HCl (g) △H=- a kJ/mol,
Ⅱ: ![]() ,且a、b、c均大于零,则断开1molH-Cl键所需的能量为- a-b-c kJ
,且a、b、c均大于零,则断开1molH-Cl键所需的能量为- a-b-c kJ
查看答案和解析>>
科目: 来源: 题型:
【题目】乙烯的产量可以用来衡量一个国家的石油化工发展水平.请回答:
(1)若将乙烯气体通入溴的四氯化碳溶液中,反应的化学方程式为: .
(2)可以用来除去乙烷中混有的乙烯的试剂是 . (填序号)
①水 ②氢气 ③溴的四氯化碳溶液 ④酸性高锰酸钾溶液
(3)在一定条件下,乙烯能与水反应生成有机物A.A的结构简式是 , 其反应类型是反应(填“取代”或“加成”).
(4)下列化学反应原理相同的是(填序号)
①乙烯使溴的四氯化碳溶液和酸性高锰酸钾溶液褪色;
②SO2使溴水和酸性高锰酸钾溶液褪色;
③SO2使品红溶液和滴有酚酞的NaOH溶液褪色.
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关化学药品的使用正确的是( )
A. 固体药品应盛放在细口瓶中
B. 将鼻孔凑到集气瓶口闻气体的气味
C. 给试管内液体加热,液体量不超过试管容积的三分之二
D. 一般用药匙或镊子取用固体药品
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com