
科目: 来源: 题型:
【题目】25 ℃时,体积均为20 mL、浓度均为0.1 mol L-1的两种酸HX、HY分别与0.1 mol L-1的NaOH溶液反应,所加NaOH溶液体积与反应后溶液的-pH的关系如图所示。下列叙述正确的是
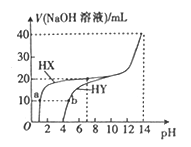
A. a点c(X-)>b点c(Y-) B. HX发生反应的离子方程式为HX+OH-=X-+H2O
C. Ka(HY)的数量级约为10-3 D. pH=7时,两种反应后的溶液中c(Y-)>c(X-)
查看答案和解析>>
科目: 来源: 题型:
【题目】下列各组元素性质或原子结构变化规律中错误的是
A.Na、Mg、Al原子最外层电子数依次增大
B.P、S、Cl元素最高化合价依次增大
C.N、O、F原子半径依次增大
D.Li、Na、K的电子层数依次增大
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)已知:将Cl2通入适量KOH溶液,产物中可能有KC1、KClO、KC1O3,且c(Cl-):c(ClO-)的值与温度高低有关。当n(KOH)=amol时,若某温度下,反应后c(Cl-):c(ClO-)=11,则溶液中c(ClO-):c(ClO3-)=_________________
(2)在P+CuSO4+H2O→Cu3P+H3PO4+H2SO4(未配平)的反应中,7.5molCuSO4可氧化P的物质的量为________mol。生成1molCu3P时,参加反应的P的物质的量为________mol。
(3)一定量的CuS和Cu2S的混合物投入足量的HNO3中,收集到气体VL(标准状况),向反应后的溶液中(存在Cu2+和SO![]() )加入足量NaOH,产生蓝色沉淀,过滤,洗涤,灼烧,得到CuO 16.0g,若上述气体为NO和NO2的混合物,且体积比为1∶1,则V的极小值为________mL。
)加入足量NaOH,产生蓝色沉淀,过滤,洗涤,灼烧,得到CuO 16.0g,若上述气体为NO和NO2的混合物,且体积比为1∶1,则V的极小值为________mL。
(4)向一定量的Fe、FeO、Fe3O4的混合物中,加入1 mol/L 硝酸的溶液100 mL,恰好使混合物全部溶解,且放出336 mL(标准状况下)的气体,向所得溶液中加入KSCN溶液,溶液无红色出现;若取相同质量的Fe、FeO、Fe3O4的混合物,加入1 mol/L的稀硫酸溶液,也恰好使混合物完全溶解(假设还原产物唯一),反应后向所得溶液中加入KSCN溶液,溶液也无红色出现,则所加入的的稀硫酸的体积是__________mL。
查看答案和解析>>
科目: 来源: 题型:
【题目】在一定条件下,二氧化硫和氧气发生如下反应:2SO2(g)+O2(g)![]() 2SO3(g) ΔH <0
2SO3(g) ΔH <0
(1)降低温度,该反应K值______,二氧化硫转化率______。(以上均填“增大”“减小”或“不变”)
(2)600 ℃时,在一密闭容器中,将二氧化硫和氧气混合,反应过程中SO2、O2、SO3物质的量变化如图所示,反应处于平衡状态的时间是______________________。
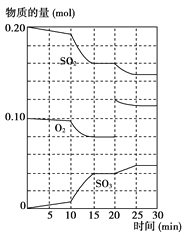
(3)据上图判断,反应进行至20 min时,曲线发生变化的原因是__________________(用文字表达)。
(4)可用上述反应中某种物理量来说明该反应已达到平衡状态的是_______。
A .SO2的生成速率与SO3的生成速率相等
B. 消耗a mol SO2的同时生成a mol SO3
C. 各组分浓度不在发生变化
D.恒容体系中压强不再发生变化
E. 恒容体系中气体密度不再变化
F. ΔH不再发生变化
G.容器里SO2、O2、SO3的浓度比是2:1:2
查看答案和解析>>
科目: 来源: 题型:
【题目】维生素C 又称“抗坏血酸”,在人体内有重要的功能.例如,能帮助人体将食物中摄取的、不易吸收的Fe3+转变为易吸收的Fe2+,这说明维生素C具有
A.酸性 B.碱性 C.氧化性 D.还原性
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法,不正确的是 ( )
A.人体缺碘,可通过食用加碘盐补碘B.缺铁性贫血,可通过食用铁强化酱油预防
C.为了防止龋齿,人人都要使用含氟牙膏D.锌摄入量过多,也会引起缺铁性贫血
查看答案和解析>>
科目: 来源: 题型:
【题目】下列叙述不科学的是( )
A.含氟牙膏可预防龋齿B.误食重金属盐后,可喝鲜牛奶急救
C.维生素可以调节人体的新陈代谢D.可用聚乙烯或聚氯乙烯塑料包装食品
查看答案和解析>>
科目: 来源: 题型:
【题目】氯气是一种重要的化工原料,是氯碱工业的主要产品之一,它是一种常用的消毒剂.
①实验室可用二氧化锰和浓盐酸反应制取氯气,反应的化学方程式是
②氯碱工业生产氯气的化学方程式为
③由于氯气贮存运输不方便,工业上常将氯气转化为漂白粉,工业上生产漂白粉的主要化学方程式是 , 在空气中漂白粉长期存放会变质而失效的原理是(用化学方程式说明) .
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)已知下列两个热化学方程式:
H2(g)+ 1/2O2(g) ![]() H2O(l) ΔH=-285.8 kJ·mol-1
H2O(l) ΔH=-285.8 kJ·mol-1
C2H4(g)+ 3O2(g) ![]() 2CO2(g)+2H2O(l) ΔH=-1411.0 kJ·mol-1
2CO2(g)+2H2O(l) ΔH=-1411.0 kJ·mol-1
实验测得H2和C2H4的混合气体共5 mol,完全燃烧生成液态水时放热4242kJ,则混合气体中H2和C3H8的体积比是____________。
(2)已知下列热化学方程式:
①CH3COOH(l) + 2O2(g) ![]() 2CO2(g) + 2H2O(l) ΔH1=―870.3 kJ·mol-1;
2CO2(g) + 2H2O(l) ΔH1=―870.3 kJ·mol-1;
②C(s) + O2(g) ![]() CO2(g) ΔH2=―393.5 kJ·mol-1;
CO2(g) ΔH2=―393.5 kJ·mol-1;
③H2(g)+1/2 O2(g)![]() H2O(l) ΔH3=―285.8 kJ·mol-1。
H2O(l) ΔH3=―285.8 kJ·mol-1。
则反应2C(s)+2H2(g)+O2(g)![]() CH3COOH(l)的ΔH为______________kJ·mol-1。
CH3COOH(l)的ΔH为______________kJ·mol-1。
(3)已知下列反应: ①SO2(g)+2OH-(aq)![]() SO32-(aq)+H2O(l) ΔH1
SO32-(aq)+H2O(l) ΔH1
②ClO- (aq)+ SO32- (aq)![]() SO42- (aq)+Cl-(aq) ΔH2
SO42- (aq)+Cl-(aq) ΔH2
③CaSO4(s)![]() Ca2+(aq)+ SO42- (aq) ΔH3 则反应
Ca2+(aq)+ SO42- (aq) ΔH3 则反应
SO2(g)+Ca2+(aq)+ClO-(aq)+2OH-(aq)![]() CaSO4(s)+H2O(l)+Cl-(aq)的ΔH=_____________。
CaSO4(s)+H2O(l)+Cl-(aq)的ΔH=_____________。
(4)已知:①碳的燃烧热ΔH1= a kJ·mol-1
②S(s)+2K(s)![]() K2S(s) ΔH2=b kJ·mol-1
K2S(s) ΔH2=b kJ·mol-1
③2K(s)+N2(g)+3O2(g)![]() 2KNO3(s) ΔH3=c kJ·mol-1
2KNO3(s) ΔH3=c kJ·mol-1
黑火药爆炸的热化学方程式为:
S(s)+2KNO3(s)+3C(s)![]() K2S(s)+N2(g)+3CO2(g) ΔH= ______________ kJ·mol-1
K2S(s)+N2(g)+3CO2(g) ΔH= ______________ kJ·mol-1
(5)①2O2(g)+N2(g)![]() N2O4(l) ΔH1 = a
N2O4(l) ΔH1 = a
②N2(g)+2H2(g)![]() N2H4(l) ΔH2=b ③O2(g)+2H2(g)
N2H4(l) ΔH2=b ③O2(g)+2H2(g)![]() 2H2O(g) ΔH3=c
2H2O(g) ΔH3=c
则反应2N2H4(l)+N2O4(l)![]() 3N2(g)+4H2O(g) ΔH4=___________________。
3N2(g)+4H2O(g) ΔH4=___________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com