
科目: 来源: 题型:
【题目】下列描述中,符合生产实际的是( )
A. 电解食盐水制得金属钠 B. 电解熔融的氧化铝制取金属铝,用铁作阳极
C. 一氧化碳高温还原铁矿石制得铁 D. 电解法精炼粗铜,用纯铜作阳极
查看答案和解析>>
科目: 来源: 题型:
【题目】用NA表示阿伏伽德罗常数的值,下列叙述中正确的是
A. 常温常压下,6g O2和26g O3混合气体中的原子总数为2NA
B. 100mL 0.1mol/L 的NaOH溶液中,所含微粒总数为0.02NA
C. 23g 金属钠变为钠离子时得到的电子数为NA
D. 标准状况下,2.24L H2O所含的原子数为0.3NA
查看答案和解析>>
科目: 来源: 题型:
【题目】元素及其化合物在生活及生产中有很多重要用途。
Ⅰ.SiC、BN、GaAs 等是人工合成半导体的材料,具有高温、高频、大功率和抗辐射等优点。请回答:
(1)基态碳原子价电子的电子轨道表达式为____,第一电离能Ga____As(填“>”、 “<”、“=”)。
(2)BN和GaAs都是原子晶体,它们的硬度和熔点BN>GaAs,原因是________________。
Ⅱ.卤素化学丰富多彩,能形成卤化物、卤素互化物、多卤化物等多种类型的化合物。
(3)拟卤素(CN)2、(SCN)2与卤素单质结构相似、性质相近,分子中所有原子都满足 8 电子结构。 (CN)2分子中氮原子的轨道杂化类型为_____,σ 键与 π 键数目之比为_______; (SCN)2对应的酸有两种,测得硫氰酸(H—S—C≡N )的沸点低于异硫氰酸(H—N=C=S),其原因是_________。
(4)①卤化物 RbICl2 在加热时会分解为晶格能相对较大的卤化物 A 和卤素互化物或卤素单质,A 的化学式为_____________;②一定条件下(SCN)2可氧化为CO32—和SO32—等离子,其中SO32—的立体构型为_________。
(5)CaC2晶体的晶胞结构与 NaCl 晶体的相似(如图1 所示),CaC2 晶体中的哑铃形 C22﹣的存在,使晶胞沿一个方向拉长。写出与C22﹣互为等电子体的微粒符号________、_______;此晶体中 1 个 C22﹣周围距离最近的Ca2+为______个;若该晶胞的边长为a、a、b(nm),则该晶体的密度为______ g·cm-3(写出表达式)。

查看答案和解析>>
科目: 来源: 题型:
【题目】微型纽扣电池在现代生活中有广泛应用。有一种银锌电池,其电极分别是Ag2O和Zn,电解质溶液为KOH溶液,电极反应为Zn+2OH--2e-![]() Zn(OH)2、Ag2O+H2O+2e-
Zn(OH)2、Ag2O+H2O+2e-![]() 2Ag+2OH-。根据上述电极反应,判断下列叙述中正确的是
2Ag+2OH-。根据上述电极反应,判断下列叙述中正确的是
A.在使用过程中,电池负极区溶液的pH增大
B.在使用过程中,电子由Ag2O极经外电路流向Zn极
C.Zn电极发生还原反应,Ag2O电极发生氧化反应
D.Zn是负极,Ag2O是正极
查看答案和解析>>
科目: 来源: 题型:
【题目】根据如图所示的N2(g)和O2(g)反应生成NO(g)过程中能量变化情况,判断下列说法错误的是 ( )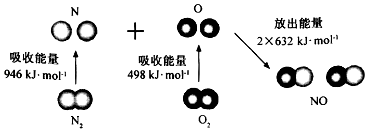
A.直观看,该反应中反应物所具有的总能量低于生成物所具有的总能量
B.2 mol气态氧原子结合生成O2(g)时,能放出498 KJ能量
C.断裂1 mol NO分子中的化学键,需要吸收632KJ能量
D.该反应的热化学方程式为:N2+O2═2NO△H=+180KJ/mol.
查看答案和解析>>
科目: 来源: 题型:
【题目】丁苯酞(J)是治疗轻、中度急性脑缺血的药物,合成J的一种路线如下:

(1)H中含氧官能团的名称为_____、_____。
(2)D的系统命名是___________;J的结构简式为_____________。
(3)由A生成B的化学方程式为_______________________,反应类型__________。
(4)C与银氨溶液反应的化学方程式为_______________________________________。
(5)H在一定条件下生成高分子化合物的结构简式为_______________。
(6)G的同分异构体中核磁共振氢谱有4组峰,且能与FeCl3溶液发生显色反应,写出其中两种符合上述条件的同分异构体的结构简式_________________________。
(7)写出由物质A、甲醛、液溴为原料合成“2一苯基乙醇”的路线图:_______________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】充分利用黄铁矿(主要成份为FeS2)对资源和环境具有重要的意义。
(1)一种酸性条件下催化氧化黄铁矿的物质转化关系如下面图Ⅰ所示。
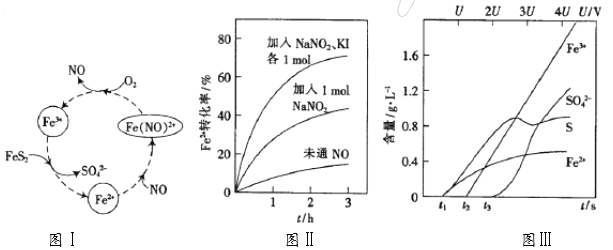
①图Ⅰ中,NO起的是_____作用;O2氧化FeS2生成Fe3+的离子方程式为____________;
②硝酸也可以将FeS2氧化为Fe3+和SO42-,但使用稀硝酸比浓硝酸的反应速率快很多,其原因是:_________。
(2)控制Fe3+的浓度、溶液体积和通入O2的速率一定,图Ⅱ表示当改变其它条件时Fe2+被氧化的转化率随时间的变化。
①加入NaNO2发生反应:3NO2-+2H+==NO3-+2NO↑+H2O。若3molNaNO2完全反应,则转移的电子数为____________________mol。
②在酸性溶液中,加入NaNO2、KI发生反应生成NO和I2,该离子反应方程式为______ ;图Ⅱ中曲线从下至上, Fe2+转化速率依次增大的原因是________。
(3)为研究FeS2作电极时的放电规律,以FeS2作阳极进行电解,由FeS2放电产生的粒子的含量与时间(t)、电压(U)之间的关系如图Ⅲ所示。
①t1至t2间FeS2发生的电极反应式为_________________。
②当电压值介于3.5U~4.4U之间时,FeS2放电所得的主要粒子为_______________。
③黄铁矿含有杂质钴和镍。若电解一段时间,c(Fe3+)=1×10-2mol·L-1时,通过计算判断:pH控制为_______不会产生Fe(OH)3沉淀;当使Co2+沉淀完全时,Fe3+_____(填:“已经”或“没有”)开始沉淀。{已知:离子浓度≤1×10–5mol·L–1认为沉淀完全;Ksp[Fe(OH)3]=3.8×10–38、Ksp[Co(OH)2]=2×10–15, ![]() = – 0.16}
= – 0.16}
查看答案和解析>>
科目: 来源: 题型:
【题目】下列叙述正确的是
A. 氧化还原反应的本质是电子的转移 B. 还原剂是在反应中得电子的物质
C. 还原剂在反应中发生还原反应 D. 置换反应不一定都是氧化还原反应
查看答案和解析>>
科目: 来源: 题型:
【题目】某工厂采用电解法处理含铬废水,耐酸电解槽用铁板作阴、阳极,槽中盛放含铬废水,原理示意图如下,下列说法不正确的是
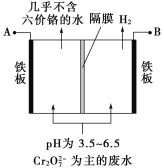
A.A为电源正极
B.阳极区溶液中发生的氧化还原反应为![]() +6Fe2++14H+===
+6Fe2++14H+===
2Cr3++6Fe3++7H2O
C.阴极区附近溶液pH降低
D.若不考虑气体的溶解,当收集到H2 13.44 L(标准状况)时,有0.1 mol ![]() 被还原
被还原
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com