
科目: 来源: 题型:
【题目】Ⅰ. (1)下列条件的改变能增大活化分子百分数的是_____________。
A.增大压强 B.增大反应物的浓度
C.升高温度 D.使用催化剂
(2)破坏(或形成)1 mol化学键所吸收(或放出)的能量称为键能。已知白磷和PCl3的分子结构如图所示,现提供以下化学键的键能(kJ·mol-1):P-P 198、Cl-Cl 243、P-Cl 331。

则反应P4(s,白磷)+6Cl2(g)=4PCl3(s)的反应热△H=__________kJ·mol-1。
Ⅱ.2SO2(g)+O2(g)![]() 2SO3(g)反应过程的能量变化如图所示。
2SO3(g)反应过程的能量变化如图所示。

已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99 kJ·mol-1。请回答下列问题:
(1)图中C表示___________,E表示______________;该反应通常用V2O5作催化剂,加V2O5会使图中B点降低,理由是____________ ;
(2)图中△H=_________kJ·mol-1。
查看答案和解析>>
科目: 来源: 题型:
【题目】A是一种常见的单质,B、C为中学常见的化合物,A、B、C均含有元素X,它们有如图所示的转化关系(部分产物及反应条件已略去)。下列推断正确的是( )
![]()
A. X元素为铝
B. 反应①和②互为可逆反应
C. X元素可能是金属,也可能是非金属
D. 反应①和②一定为氧化还原反应
查看答案和解析>>
科目: 来源: 题型:
【题目】完成下列实验所选择的装置或仪器(夹持装置已略去)正确的是( )
A | B | C | D | |
实验 | 用CCl4提取 溴水中的Br2 | 除去氢氧化铁 胶体中的氯化钠 | 从KI和I2的固体混合物中回收I2 | 配制100 mL0.1 mol·L-1 NaCl溶液 |
装置或 仪器 |
|
|
|
|
A. A B. B C. C D. D
查看答案和解析>>
科目: 来源: 题型:
【题目】下列除去杂质(括号的物质为杂质)的方法中,错误的是( )
A. FeCl3溶液(FeCl2):通入适量Cl2
B. CO(CO2):通过NaOH溶液洗气后干燥
C. Fe2O3(Al2O3):加入足量NaOH溶液
D. CO2(HCl):通过饱和Na2CO3溶液洗气后干燥
查看答案和解析>>
科目: 来源: 题型:
【题目】A和B是前三周期的元素,它们的离子A2﹣、B3+具有相同的电子层结构。下列说法中正确的是( )
A.原子序数:A>BB.原子半径:A>B
C.离子半径:A2﹣>B3+D.质子数:A>B
查看答案和解析>>
科目: 来源: 题型:
【题目】下表是不同温度下水的离子积常数:
温度/℃ | 25°C | 99°C |
水的离子积常数 | 1×l0-14 | 1×l0-12 |
试回答以下问题(设混合后溶液的体积为原两溶液体积之和):
(1)25℃时,将pH=11的苛性钠溶液V1L与pH=1的稀硫酸V2L混合,所得混合溶液的pH=2,则V1:V2 =___________。此溶液中各种离子的浓度由大到小的顺序是_________________。
(2)99℃时,将pH=2的硫酸和pH=10的氢氧化钠溶液等体积混合,则混合溶液中的c(H+)=__mol·L-1。
(3)假设H2A是强酸,但常温下0.1mol·L-1H2A的溶液中c (H+)=0.11mol L-1,则NaHA溶液呈___________性(填“酸”、“碱”或“中”),0. lmol·L-1的NaHA溶液的c(H+)________0. 0lmol L-1 (填“>”、“<”或“=”);H2A溶液与Na2A溶液反应的离子方程式为_____________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】SO2和H2S会对环境和人体健康带来极大的危害,工业上采取多种方法减少这些有害气体的排放,回答下列方法中的问题。
(1)用氨水除去SO2:
已知 25℃,H2SO3的Ka1=1.3×10-2,Ka2=6.2×10-8,NH3·H2O的 Kb=1.8×l0-5。
①试写出H2SO3在水溶液中的电离方程式__________________,从电离平衡的角度解释Ka1、Ka2差别很大的原因_________________。
②若氨水的浓度为0.02 mol·L-1,溶液中的c(OH-)=____________mol·L-1、将SO2通入该氨水中,当溶液中的c(SO32-)/ c(HSO3-)=6.2时,溶液的pH=_____________。
(2)生物脱H2S:
原理为:H2S+Fe2(SO4)3=S↓+2FeSO4+H2SO4
4FeSO4+O2+2H2SO4=2Fe2(SO4)3+2H2O
①硫杆菌存在时,FeSO4被氧化的速率是无菌时的5×105倍,该菌的作用是_______________ 。
②由图1和图2判断使用硫杆菌的最佳条件为________________ ,若反应温度过高,反应速率下降,其原因是__________________________ 。
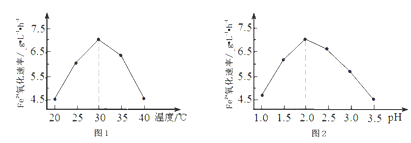
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com