
科目: 来源: 题型:
【题目】硫酸亚铁铵[(NH4)2Fe(SO4)2]是分析化学中的重要试剂,在不同温度下加热分解产物不同。设计如图实验装置(夹持装置略去),在500℃时隔绝空气加热A中的硫酸亚铁铵至分解完全,确定分解产物的成分。

(1)B装置的作用是___________________。
(2)实验中,观察到C中无明显现象,D中有白色沉淀生成,可确定产物中一定有_______气体产生,写出D中发生反应的离子方程式_______。若去掉C,是否能得出同样结论并解释其原因______________。
(3)A中固体完全分解后变为红棕色粉末,某同学设计实验验证固体残留物仅为Fe2O3,而不含FeO,请完成表中内容。(试剂,仪器和用品自选)
实验步骤 | 预期现象 | 结论 |
取少量A中残留物于试管中,加入适量稀硫酸,充分振荡使其完全溶解;___________ | ____________________ | 固体残留物仅为Fe2O3 |
(4)若E中收集到的气体只有N2,其物质的量为x mol,固体残留物Fe2O3,的物质的量为y mol,D中沉淀物质的量为z mol,根据氧化还原反应的基本规律,x、y和z应满足的关系为______________。
(5)结合上述实验现象和相关数据的分析,完成硫酸亚铁铵[(NH4)2Fe(SO4)2]在500℃时隔绝空气加热完全分解的化学方程式__________________。
(6)用氧化还原滴定法测定制备得到的TiO2试样中的TiO2的质量分数:在一定条件下,将TiO2溶解并还原为Ti3+,再以KSCN溶液作为指示剂,用硫酸铁铵[NH4Fe(SO4)2]标准溶液滴定Ti3+至全部生成Ti4+。
①TiCl4水解生成TiO2·xH2O的化学方程式为_______________。
②滴定终点的现象是_______________。
③滴定分析时,称取TiO2试样0.2 g,消耗0.1 mol·L-1NH4Fe(SO4)2标准溶液20mL,则TiO2的质量分数为_______________。
④若在滴定终点读取滴定管刻度时,俯视标准溶液的液面,使其测定结果_______(填“偏大”“偏小”或“无影响”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关实验的说法中正确的是
A.蒸馏时,温度计的水银球应伸入液面下
B.在持续加热的情况下,向蒸馏烧瓶内补加碎瓷片
C.重结晶时,趁热过滤的目的是减少被提纯物质的损失
D.在萃取实验中,可以用乙醇萃取溴水中的溴
查看答案和解析>>
科目: 来源: 题型:
【题目】
A. 合成ATP、DNA、RNA、脂肪时,都需要磷酸盐作原料
B. 组成生物体的最基本元素有H、C、O、N
C. 脂质分子相比于糖类,H的含量较高,O的含量较少
D. 组成叶绿素的元素除了C、H、O、N外还有Fe
查看答案和解析>>
科目: 来源: 题型:
【题目】已知反应N2O4(g)![]() 2NO2(g) ΔH>0,平衡体系中总质量(m总)与总物质的量(n总)之比M(M=
2NO2(g) ΔH>0,平衡体系中总质量(m总)与总物质的量(n总)之比M(M=![]() )在同温度下随压强的变化曲线如图所示。下列说法正确的是:
)在同温度下随压强的变化曲线如图所示。下列说法正确的是:
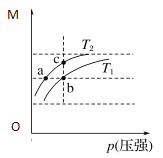
A. 温度:T1<T2
B. 平衡常数:K(a)=K(b)<K(c)
C. 反应速率:vb<va
D. 当M=69 g·mol-1时,n(NO2)∶n(N2O4)=1∶1
查看答案和解析>>
科目: 来源: 题型:
【题目】0.5L 1mol/L FeCl3溶液中的Cl-的物质的量浓度为
A. 3 mol/L B. 1.5 mol/L C. 1 mol/L D. 0.5 mol/L
查看答案和解析>>
科目: 来源: 题型:
【题目】O2和O3是氧元素的两种单质,根据其分子式完成下列各题:
(1)等质量的O2和O3所含分子个数比为 , 原子个数比为 , 分子的物质的量之比为 .
(2)等温等压下,等体积的O2和O3所含分子个数比为 , 原子个数比为质量比为 .
(3)设NA为阿伏伽德罗常数的数值,如果a g氧气中含有的分子数为b,则c g氧气在标准状况下的体积约是(用含NA的式子表示).
查看答案和解析>>
科目: 来源: 题型:
【题目】已知H+(aq) + OH—(aq) = H2O(l) △H1 = -57.3 kJ·mol—1 CH3COO-(aq) + H2O![]() CH3COOH(aq) + OH-(aq) ΔH2 =aKJ/mol,下列说法正确的是:
CH3COOH(aq) + OH-(aq) ΔH2 =aKJ/mol,下列说法正确的是:
A. a = 57.3
B. a > 57.3
C. 0<a<57.3
D. 增大c(CH3COO-),a值增大
查看答案和解析>>
科目: 来源: 题型:
【题目】按要求填空
(1)用14.2g无水硫酸钠配制成500mL溶液,其物质的量浓度为mol/L.
(2)若从中取出50mL,其物质的量浓度为mol/L;含溶质质量g.
(3)若将这50mL溶液用水稀释到100mL,所得溶液中Na+的物质的量浓度为mol/L,SO42﹣的物质的量浓度为mol/L.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com