
科目: 来源: 题型:
【题目】下列四种装置中,均盛200mL的溶液.①0.005mol/LCuSO4溶液,②0.01mol/LH2SO4 , ③ZnCl2溶液,④KCl溶液. 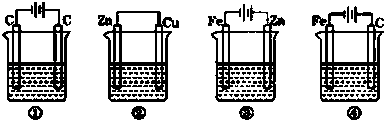
(1)上述四种装置中,为电解池的是(用编号回答),装置②中两电极的电极反应式分别是:Zn极: , Cu极: .
(2)装置④中,通电一开始,Fe极上发生的电极反应式是;C极上发生的电极反应式是 .
(3)工作一段时间后,测得导线上均通过0.002mol电子,则上述装置 ②中生成气体的体积是mL(溶液体积变化忽略不计).
查看答案和解析>>
科目: 来源: 题型:
【题目】下列不属于共价键成键因素的是( )
A.共用电子对在两原子核之间出现的概率高
B.共用的电子必须配对
C.两原子体积大小要适中
D.成键后体系能量降低,趋于更稳定
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是( )
A.氢键具有方向性和饱和性
B.分子内键能越小,表示该分子受热越难分解
C.在分子中,两个成键的原子间的距离叫键长
D.对于由分子构成的物质,相对分子质量越大,其熔沸点一定越高
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是( )
A.因为 p 轨道是哑铃形,所以 p 能级上电子运行的轨迹就是哑铃形
B.M 能层有 3s、3p、3d 能级,共 9 个轨道
C.Li 原子中只有 3 个电子,故 Li 原子核外只有 2 个轨道
D.第 n 能层的原子轨道数为 2n2
查看答案和解析>>
科目: 来源: 题型:
【题目】近年来运用有机合成的方法制备出了许多具有下图所示立体结构的环状化合物,如

(1)写出上述物质Ⅱ的分子式_____________;
(2)Ⅰ、Ⅱ、Ⅲ之间的关系是_____________;
A.同素异形体 B.同系物 C.同分异构体 D.同种物质
(3)利用结构Ⅰ能解释苯的下列事实的是_____________,利用结构Ⅱ或Ⅲ不能解释苯的下列事实的是_____________
A.苯不能使酸性KMnO4溶液褪色
B.苯不能与溴水因发生化学反应而使溴水褪色
C.在一定条件下能和H2发生加成反应
查看答案和解析>>
科目: 来源: 题型:
【题目】X、Y两元素可形成X2Y3型化合物,则X、Y原子基态时最外层的电子排布可能是( )
A.X:3s23p1 Y:3s23p5
B.X:2s22p3 Y:2s22p4
C.X:3s23p2 Y:3s23p4
D.X:3s2 Y:2s22p3
查看答案和解析>>
科目: 来源: 题型:
【题目】氨是一种重要的化工原料。
Ⅰ、某学习小组同学设计了下图所示的实验装置(部分夹持仪器未画出),进行氨气实验室制备且探究氨气的还原性及产物的检验。
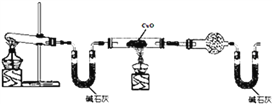
实验现象为:黑色CuO变为红色;干燥管中无水CuSO4粉末变为蓝色;同时生成一种无色无味无污染的气体。
(1)请写出大试管中反应的化学方程式_______________________________________。
(2)请写出氨气与CuO反应的化学方程式_________________________________________。
(3)该装置存在明显缺陷,请指出存在的问题______________________。
Ⅱ、哈伯因为将氮气和氢气在一定条件下合成氨气的成果面获得1918年诺贝尔化学奖。现将1molN2和3molH2充入一恒容的密闭容器中,使其在一定条件下达到平衡N2+3H2![]() 2NH3,下列哪些状态一定是达到平衡的状态?(_____)
2NH3,下列哪些状态一定是达到平衡的状态?(_____)
A.混合气体的平均相对分子质量不随时间改变而改变的状态
B.N2、H2、NH3的总物质的量不随时间改变而改变的状态
C.混合气体的密度不随时间改变而改变的状态
D.单位时间内0.1molNH3分解的同时,有0.05molN2生成的状态
Ⅲ、下图是一种电化学制备NH3的装置,图中陶瓷在高温时可以传输H+。
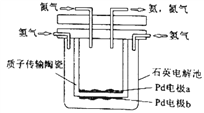
(1)H+经质子传输陶瓷由_____________流向_______________。(选填“a”或“b”)
(2)阴极发生的电极反应为_________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】铝元素含量居金属首位, 主要存在于铝土矿(主要成分为Al2O3,还含有Fe2O3、FeO、SiO2)中。铝的单质及其化合物在生产、生活、科研等领城应用广泛。
Ⅰ、工业上用铝土矿制备铝的某种化合物的工艺流程如下:
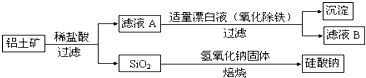
(1)在滤液A中加入漂白液,目的是氧化除铁,所得滤液B显酸性。
①该过程中涉及某氧化还原反应如下,请完成:
Fe2++□ClO-+□ ═□Fe(OH)3↓+□Cl-+□__________
②检验滤液B中是否还含有铁元素的方法为:_________________________
③将滤液B中的铝元素以沉淀形式析出,可选用的最好试剂为__________(选填代号)
A.氢氧化钠溶液 B.硫酸溶液 C.氨水 D.二氧化碳
④由滤液B制备氯化铝晶体涉及的操作为:边滴加浓盐酸边蒸发浓缩、__________(填操作名称)、过滤、洗涤。
Ⅱ、明矾(KAl(SO4)2·12H2O)在日常生活、生产中也占有一席之地。
(1)明矾曾经是净水明星,用离子方程式表示其净水原理_____________________________。
(2)明矾净水时,若不慎过量会有一定程度的副作用。将含有明矾的水溶液中加入Ba(OH)2溶液至铝离子恰好完全沉淀,并且过滤,就可以避免,请用离子反方程式描述其过程______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室中的碘水一般是将碘单质溶于KI溶液配制而成,发生反应:I-+I2I3-(主要溶质为KI3或KI·I2)。下列说法不正确的是
A.该溶液遇淀粉显蓝色
B.该溶液见光易变质,应用棕色试剂瓶密封保存
C.采用此法配制碘水的目的是为了提高碘水的浓度
D.该溶液中通入SO2后,溶液由中性变为强酸性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com