
科目: 来源: 题型:
【题目】(双选)蔗糖酯是联合国国际粮农组织和世界卫生组织推荐使用的食品乳化剂。某蔗糖酯由蔗糖与硬脂酸乙酯合成,反应如下: 。有关说法不正确的是( )
。有关说法不正确的是( )
A. 蔗糖酯也是高级脂肪酸的甘油酯
B. 合成该蔗糖酯的反应属于取代反应
C. 蔗糖分子中含有8个羟基
D. 该蔗糖酯在稀硫酸的作用下水解,水解过程中只有硬脂酸和葡萄糖两种产物
查看答案和解析>>
科目: 来源: 题型:
【题目】H3PO2(次磷酸)是一种一元弱酸,H3PO2易溶于水且具有较强的还原性。
(1)H3PO2的结构式为____________________。
(2)H3PO2在水溶液中的电离方程式为_____________________。
(3)不断将新制的PH3通入搅拌的碘悬浮液中,直至碘的颜色消失,可得到次磷酸和氢碘酸,则该反应中氧化产物与还原产物的物质的量之比为__________________。
(4)酸性条件下,H3PO2可将Cr2O72-还原为Cr3-,其本身被氧化为磷酸,该反应的离子方程式为___________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】右图是反应CO(g)+2H2(g)═CH3OH(g)进行过程中的能量变化曲线.下列相关说法正确的是( ) 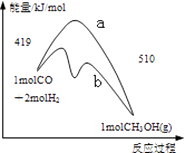
A.该反应是吸热反应
B.使用催化剂后反应热减小
C.热化学方程式为CO(g)+2H2(g)═CH3OH(g)△H=﹣510 kJmol﹣1
D.曲线a表示不使用催化剂时反应的能量变化,曲线b表示使用催化剂后的能量变化
查看答案和解析>>
科目: 来源: 题型:
【题目】根据图示回答下列问题:
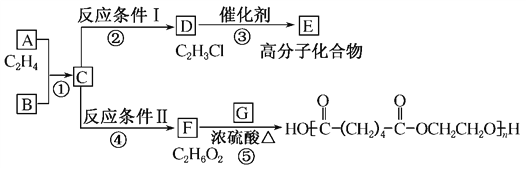
(1)写出A、E、G的结构简式:A________,E________,G________。
(2)反应②的化学方程式(包括反应条件)是_________________________,反应④的化学方程式(包括反应条件)是________________________。
(3)写出①、③、⑤的化学方程式及反应类型:
①___________________________________________________;
③___________________________________________________;
⑤___________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】根据下列热化学方程式,判断氢化物的稳定性顺序正确的是( ) ![]() N2(g)+
N2(g)+ ![]() H2(g)=NH3(g)△H=﹣46.19kJmol﹣1
H2(g)=NH3(g)△H=﹣46.19kJmol﹣1![]() H2(g)+
H2(g)+ ![]() Cl2(g)=HCl(g)△H=﹣92.36kJmol﹣1
Cl2(g)=HCl(g)△H=﹣92.36kJmol﹣1![]() I2(g)+
I2(g)+ ![]() H2(g)=HI(g)△H=﹣4.74kJmol﹣1 .
H2(g)=HI(g)△H=﹣4.74kJmol﹣1 .
A.HCl>NH3>HI
B.HI>HCl>NH3
C.HCl>HI>NH3
D.NH3>HI>HCl
查看答案和解析>>
科目: 来源: 题型:
【题目】现有反应:
A.CaCO3 ![]() CaO+CO2↑
CaO+CO2↑
B.Zn+H2SO4=ZnSO4+H2↑
C.C+CO2 ![]() 2CO
2CO
D.2KOH+H2SO4═K2SO4+2H2O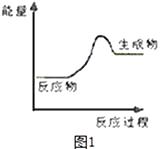
(1)上述四个反应中属于氧化还原反应且反应过程中能量变化符合图1的是(填反应序号).
(2)在常温下,上述四个反应中可用于设计原电池的是(填反应序号),根据该原电池回答下列问题:
①负极材料是 , 负极发生(填“氧化”或“还原”)反应;正极反应式为 .
②当导线中有1mol电子通过时,理论上发生的变化是(填序号). (相对原子质量:H1,Zn65)
a.溶液增重32.5g b.溶液增重31.5g
c.析出1g H2 d.析出11.2LH2
(3)对于反应B,将足量且等量的形状相同的锌块分别加入到等浓度等体积的两份稀硫酸X、Y中,同时向X中加入少量饱和CuSO4溶液,发生反应生成氢气的体积(V)与时间(t)的关系如图2所示. 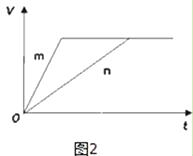
①m曲线表示锌与稀硫酸(填“X”或“Y”)反应.
②锌分别与稀硫酸X、Y反应时,反应速率不同的原因是(填序号).
a.CuSO4作催化剂
b.加入硫酸铜溶液增大了c(SO42﹣)
c.Zn首先与Cu2+反应,生成的Cu与Zn、稀硫酸构成原电池
d.加入硫酸铜溶液增大了溶液体积.
查看答案和解析>>
科目: 来源: 题型:
【题目】利用废碱渣(主要成分为Na2CO3)处理硫酸厂尾气中的SO2,可制得无水Na2SO3(成品),其流程如图所示。
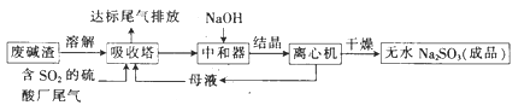
(1)某硫酸厂排放出的尾气中SO2的含量特别髙,而废碱渣的量不足,此时“吸收塔”内发生反应的离子方程式为_______________(不考虑H2O与SO2反应)。
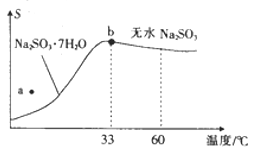
(2)亚硫酸钠的溶解度曲线如图所示,则上述流程中“结晶”的方法是___________(填“蒸发结晶”或“降温结晶”),图中a点所示分散系类别为____________(填“浊液”“胶体”或“溶液”)。
(3)仅用BaCl2、H2O2和过量稀盐酸的混合溶液难以检出“成品”中的SO32-,原因是“成品”中含有某种杂质阴离子。
①该杂质阴离子为________________(填离子符号)。
②25℃时,部分钡盐的Ksp如下表所示。
化学式 | BaSO4 | BaSO3 |
Ksp | 1.1×10-10 | 5.5×10-7 |
将得到的“成品”溶于水,测得溶液中SO32-的浓度为0.5mol L-1,为杂质阴离子浓度的10倍,向该溶液中加入等体积、0.5mol·L-1的BaCl2溶液,充分反应后c(Ba2+)=_______mol L-1。(混合时溶液体积的变化忽略不计)
(4)某同学采用如下方法检验SO32-:
![]()
①洗涤时使用的试剂最好为____________(填字母)。
a.稀HNO3 b.蒸馏水 c.稀H2SO4
②根据上述流程中的数据(w、x、y)_____________ (填“能”或“不能”)计算出成品试样中SO32-的百分含量,若能,则SO32-的百分含量为 (若不能,则此空不填);若不能,则理由是_____________(若能,则此空不填)。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列各组物质之间的相互反应,说法错误的是( )
A.CaO与H2O是吸热反应
B.HCl与KOH是放热反应
C.CH4燃烧是放热反应
D.Ba(OH)2·8H2O与NH4Cl是吸热反应
查看答案和解析>>
科目: 来源: 题型:
【题目】A,B,C,D,E,F六种化合物,其中A,B,C,D,E均由短周期元素组成,焰色反应均为黄色,B、C、E均由三种元素组成.B、C的组成元素相同,且C的摩尔质量比B大80g/mol,回答:
(1)固体化合物A为浅黄色粉末,该化合物中含有的化学键为
A.离子键
B.极性共价键
C.非极性共价键
D.氢键
(2)下表为B与F实验的部分内容
①在含B的溶液中加入稀H2SO4 , 产生浅黄色浑浊和使澄清石灰水变浑浊的无色有刺激性气味的气体 |
②20mL沸水中滴加F的饱和溶液1~2mL所得液体呈红褐色 |
③将实验②得到的红褐色液体加热蒸发,灼烧,最终得到红棕色固体 |
写出B与稀H2SO4反应的离子方程式
写出②中反应的化学方程式
(3)现由6种粒子Mn2+、MnO ![]() 、H+、H2O、X2Y
、H+、H2O、X2Y ![]() (C中含有的阴离子),XY
(C中含有的阴离子),XY ![]() 完成一个离子方程式,已知Mn2+为还原剂,得到1molMnO
完成一个离子方程式,已知Mn2+为还原剂,得到1molMnO ![]() 需氧化剂的物质的量为mol
需氧化剂的物质的量为mol
(4)化合物D和E相互转化D ![]() E,若有D和ExH2O的混合物13.04g,加热到完全反应后,气体产物通过浓H2SO4增重3.42g,剩余气体通过碱石灰增重2.20g,则混合物中D的质量为g,ExH2O的化学式为 .
E,若有D和ExH2O的混合物13.04g,加热到完全反应后,气体产物通过浓H2SO4增重3.42g,剩余气体通过碱石灰增重2.20g,则混合物中D的质量为g,ExH2O的化学式为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com