
科目: 来源: 题型:
【题目】A,B,C,D 4种元素的核电荷数依次增大,它们的离子的电子层数相同且最外层电子数均为8.A原子的L层电子数与K,M层电子数之和相等,D原子的K,L层电子数之和等于电子总数的一半.请回答下列问题:
(1)4种元素的符号依次是A , B , C , D . 它们的原子半径由大到小的顺序是 .
(2)试写出4种元素的离子结构示意图:A , B , C , D . 它们离子的半径由大到小的顺序 .
(3)它们最高价氧化物对应水化物的化学式分别是 , 分别比较它们酸性和碱性的强弱 .
(4)写出能够生成的气态氢化物的化学式: , 比较其稳定性: , 理由是 .
查看答案和解析>>
科目: 来源: 题型:
【题目】某二价金属的碳酸盐和碳酸氢盐的混合物,跟足量的稀盐酸反应,消耗H+和生成CO2物质的量之比为6:5,则该混合物中碳酸盐和碳酸氢盐的物质的量之比是( )
A. 1:1 B. 1:3 C. 1:2 D. 1:4
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g),反应过程如下。
2P(s)+3Cl2(g)=2PCl3(g) ΔH=-612kJ/mol
2P(s)+5Cl2(g)=2PCl5(g) ΔH=-798kJ/mol
气态PCl5生成气态PCl3和Cl2的热化学方程式为________.
(2)不同温度下反应CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH1的平衡常数如下表所示。
CO2(g)+H2(g) ΔH1的平衡常数如下表所示。
温度/℃ | 400 | 500 | 800 |
平衡常数K | 9.94 | 9 | 1 |
则ΔH1______0(填“<”“>”);在500℃时,把等物质的量浓度的CO和H2O(g)充入反应容器,达到平衡时c(CO)=0.005mol/L、c(H2)=0.015mol/L,则CO的平衡转化率为______。
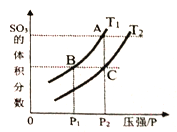
(3)在一定体积的绝热密闭容器中,对于反应2SO2(g)+O2(g)![]() 2SO3(g) ΔH<0,判断该反应达到平衡状态的标志是_____________。
2SO3(g) ΔH<0,判断该反应达到平衡状态的标志是_____________。
A.SO2和SO3浓度相等
B.容器中混合气体的密度保持不变
C.容器中气体的温度保持不变
D.SO3的生成速率与SO2的消耗速率相等
当温度为T1、T2时,平衡体系SO3的体积分数随压强变化曲线如上图所示。则T1____T2 (填“>”或“<");理由是_____。如果想加快正反应的速率,除了改变温度,还可以用_______方法。
查看答案和解析>>
科目: 来源: 题型:
【题目】如下图所示,某同学设计了一个燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X 为阳离子交换膜。下列有关说法正确的是
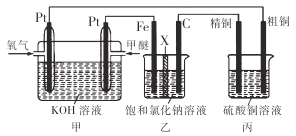
A. 乙装置中铁电极为阴极,电极反应式为Fe-2e-=Fe2+
B. 反应一段时间后,乙装置中生成的氢氧化钠在铁极区
C. 反应一段时间后,丙装置中硫酸铜溶液浓度保持不变
D. 通入氧气的一极为正极,发生的电极反应为O2-4e-+2H2O=4OH-
查看答案和解析>>
科目: 来源: 题型:
【题目】乙烯的产量可以用来衡量一个国家的石油化工发展水平.请回答:
(1)乙烯的结构式是 .
(2)若将乙烯气体通入溴的四氯化碳溶液中,反应的化学方程式为 .
(3)可以用来除去乙烷中混有的乙烯的试剂是 . (填序号)
①水 ②氢气 ③溴水 ④酸性高锰酸钾溶液
(4)在一定条件下,乙烯能与水反应生成有机物A,A的结构简式是 , 其反应类型是反应(填“取代”或“加成”).
(5)下列化学反应原理相同的是(填序号).
①乙烯使溴的四氯化碳溶液和酸性高锰酸钾溶液褪色
②SO2使溴水和酸性高锰酸钾溶液褪色
③SO2使品红溶液和滴有酚酞的NaOH溶液褪色.
查看答案和解析>>
科目: 来源: 题型:
【题目】25℃时,用浓度为0.1000mol/L的NaOH溶液滴定20.00mL 浓度均为0.1000mol/L 的三种酸HX、HY、HZ,滴定曲线如图所示。下列说法不正确的是
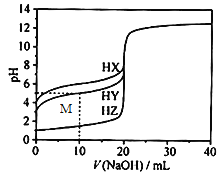
A. 该滴定过程能选择酚酞作为指示剂
B. HZ是强酸
C. HX消耗NaOH溶液20.00mL时,溶液pH>7
D. M 点处的溶液中c(Na+)>c(Y-)>c(H+)>c(OH-)
查看答案和解析>>
科目: 来源: 题型:
【题目】在含有Fe3+、Fe2+、Al3+、Na+的稀溶液中加入足量Na2O2固体,充分反应后,再加入过量稀盐酸,完全反应,则离子数目没有变化的是( )
A. Fe3+ B. Al3+ C. Fe2+、 D. Na+
查看答案和解析>>
科目: 来源: 题型:
【题目】某实验小组探究少量Cl2和FeBr2反应的过程。
(1)配制FeBr2溶液:
ⅰ. 配制50mL1.0mol/LFeBr2溶液;
ⅱ. 上述溶液呈淡黄色。取少量此溶液,向其中滴入KSCN溶液,变为浅红色。
①配制50mL1.0mol/LFeBr2溶液常加少量HBr是为了_____________________。
②由ⅱ可知,此FeBr2溶液呈黄色的原因是其中含有________,用离子方程式解释产生其原因:_____________________。
(2)氯气和FeBr2反应实验操作及现象如下:

据此甲同学得出结论:少量Cl2既能和Fe2+又能和Br-发生氧化还原反应。
①Cl2和Fe2+发生反应的离子方程式是________________。
②乙同学认为上述实验不能证明Cl2和Br-发生反应,理由是_____________。
③乙同学改进实验如下:在上述FeBr2溶液中加入过量铁粉,取上层清液2 mL,向其中滴加3滴饱和氯水后,再加入CCl4,振荡后静置,观察现象。乙得出结论:少量Cl2只与Fe2+反应,不与Br-反应。乙得出该结论依据的实验现象是____________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】在pH = 14的溶液中,下列离子能大量共存的是
A. Na+、Al3+ 、NO3-、Cl- B. Na+、SO4 2-、Cl- 、NH4+
C. K+、Cl-、Na+、HCO3- D. S2-、NO3-、Na+、K+
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)科学家发现某药物M能治疗血管疾病,是因为它在人体内能释放出一种“信使分子”D。已知M的相对分子质量为227,由C、H、O、N四种元素组成,C、H、N的质量分数依次为15.86%、2.20%和18.50%,则M的分子式是______。D是双原子分子,相对分子质量为30,则D的分子式为_____。
(2)油脂A经下列途径可得到M:
![]()
图中②的提示:R—OH+HO—NO2![]() R—O—NO2+H2O(R代表烃基)
R—O—NO2+H2O(R代表烃基)
反应②的化学方程式为____________。
(3)C是B与乙酸在一定条件下反应生成的化合物,相对分子质量为134,写出C所有可能的结构简式:_________________。
(4)若将0.1 mol B与足量的金属钠反应,则需消耗_____ g金属钠。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com