
科目: 来源: 题型:
【题目】常温下,向10 mL 1 mol/L HCl溶液中滴加等物质的量浓度的CH3COONa溶液。所得混合液的pH与加入CH3COONa溶液的体积(V)的变化如下图所示。下列说法不正确的是

A. 常温下,CH3COOH的电离常数约为2×10-5
B. 随着V的增加,混合液中水的电离程度先增加后减小
C. 当V=20mL时,混合液中c(Na+) >c(CH3COO-)> c(Cl-)>c(H+) >c(OH-)
D. 当混合液的pH=7时,混合液中c(CH3COOH)=c(Cl-)
查看答案和解析>>
科目: 来源: 题型:
【题目】设 NA 为阿伏加德罗常数的值,下列说法正确的是
A. 标准状况下, 1.12 L SO3 中含有的质子数目为 2NA
B. KIO3与HI溶液反应时.生成0.1mol I2转移的电子数为0.2NA
C. 标况下11.2LNO和11.2LO2混合后所得气体分子数为NA
D. 由1molCH3COONa和少量CH3COOH形成的中性溶液中,CH3COOˉ数目为NA个
查看答案和解析>>
科目: 来源: 题型:
【题目】白酒、食醋、蔗糖、淀粉是家庭厨房中常用的烹调剂,利用这些物质能完成的实验是( )
A.鉴别食盐和小苏打
B.检验食盐中是否含KIO3
C.检验自来水中是否含有氯离子
D.检验白酒中是否含甲醇
查看答案和解析>>
科目: 来源: 题型:
【题目】血红蛋白(Hb)易与O2结合生成HbO2, CO吸入肺中发生反应:CO+HbO2![]() O2+HbCO,平衡常数K=220。HbCO的浓度达到HbO2浓度的0.02倍,会使人智力受损。假设空气中氧气的体积分数为20%。据此,下列结论错误的是
O2+HbCO,平衡常数K=220。HbCO的浓度达到HbO2浓度的0.02倍,会使人智力受损。假设空气中氧气的体积分数为20%。据此,下列结论错误的是
A. 当HbCO的浓度达到HbO2浓度的0.02倍时,反应达到平衡
B. 可以把CO中毒的病人放入高压氧仓中解毒
C. 血红蛋白结合CO的能力强于O2
D. 空气中CO的体积分数不能超过1.8×10-5,否则对人体有害
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:N2(g)+3H2(g)![]() 2NH3(l)△H=﹣132kJ/mol,蒸发1mol NH3(l)需要吸收的能量为20kJ,相关数据如下
2NH3(l)△H=﹣132kJ/mol,蒸发1mol NH3(l)需要吸收的能量为20kJ,相关数据如下
H2(g) | N2(g) | NH3(g) | |
1mol分子中的化学键形成时要释放出的能量/kJ | 436 | 946 | a |
一定条件下,在体积1L的密闭容器中加入1molN2(g)和3molH2(g)充分反应,生成NH3(g)放出热量QkJ,下列说法正确的是

A.上图可表示合成氨过程中的能量变化
B.a的数值为1173
C.Q的数值为92
D.其它条件相同,反应使用催化剂时释放出的能量大于无催化剂时释放出的能量
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于胶体,判断不正确的是( )
A. 胶体的本质特征是胶体粒子直径在1nm~100nm
B. 煮沸饱和FeCl3溶液可以制得Fe(OH)3胶体
C. 丁达尔现象可以用来区别胶体和溶液
D. 溶液和胶体的分散质能通过滤纸孔隙
查看答案和解析>>
科目: 来源: 题型:
【题目】反应4NH3+5O24NO+6H2O在5L的密闭容器中进行,半分钟后,NO的物质的量增加了3mol,则此反应的平均反应速率v(H2O)为( )
A.0.02molL﹣1s﹣1
B.1.5molL﹣1min﹣1
C.0.03molL﹣1s﹣1
D.1.8molL﹣1min﹣1
查看答案和解析>>
科目: 来源: 题型:
【题目】氮化铝(AlN)是一种新型无机非金属材料。某AlN样品仅含有Al2O3杂质,为测定AlN含量,设计如下两种实验方案。(已知:AlN+NaOH+ H2O==NaAlO2+ NH3↑)
【方案1】取一定量的样品,用以下装置测定样品中AlN的纯度(夹持装置已略去)。
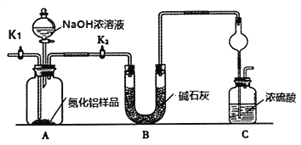
(1)上图C装置中球形干燥管的作用是_________________。
(2)完成以下实验步骤:组装好实验装置,检查装置气密性并加入实验药品,关闭K1,打开K2 ,打开分液漏斗活塞,加入NaOH浓溶液,至不再产生气体。打开K1,通入氮气一段时间,测定C装置反应前后的质量变化。
①检验装置气密性的方法是__________________________
②通入氮气的目的是__________________________________________________。
(3)由于装置存在缺陷,导致测定结果偏高,请提出改进意见__________________。
【方案2】用下图装置测定m g样品中AlN的纯度(部分夹持装置已略去)。
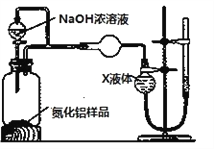
(4)为测定生成气体的体积,量气装置中的X液体可以是___________
A.CCl4 B.H2O C.NH4Cl溶液 D.苯
(5)若m g样品完全反应,测得生成气体的体积为V mL(已转换为标准状况),则AlN的质量分数是_____________________。
若其他操作均正确,但反应结束后读数时,右侧量气管中液面高于左侧球型管中液面,则最后测得AlN的质量分数会_________(填“偏高”“偏低”或“无影响”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】2molA与2molB混合于2L的密闭容器中,发生如下反应,2A(g)+3B(g) ![]() 2C(g)+2D(g),2s后A的转化率为50%,测得v(D)=0.25mol/(L·s)。下列推断不正确的是
2C(g)+2D(g),2s后A的转化率为50%,测得v(D)=0.25mol/(L·s)。下列推断不正确的是
A. z=2
B. 2s后,容器内的压强是初始的7/8倍
C. 2s时,C的体积分数为2/7
D. 2s后,B的浓度为0.5mol/L
查看答案和解析>>
科目: 来源: 题型:
【题目】卤族元素在化学中有着极为广泛的应用。
Ⅰ. 由于氟的特殊化学性质,它和其他卤素在单质及化合物的制备与性质上存在较明显的差异。
(1)化学家研究发现,SbF5能与[MnF6]2-离子反应得到MnF4,SbF5转化成稳定离子[SbF6]-的盐。而MnF4很不稳定,受热易分解为MnF3和F2。根据以上研究写出以K2MnF6和SbF5为原料,在423 K 的温度下制备F2的化学方程式:________________________________________________。
(2)现代工业以电解熔融的氟氢化钾(KHF2)和氟化氢(HF)混合物制备氟单质,电解制氟装置如图所示。

电解制氟时,要用镍铜合金隔板将两种气体产物严格分开的原因是______________________。
(3)HF的水溶液是氢氟酸,能用于蚀刻玻璃,其化学反应方程式为: ____________________。
Ⅱ. 实验室常用高锰酸钾固体与浓盐酸反应制备氯气。将0.08mol KMnO4固体加热一段时间后,收集到a molO2;向反应后残留的固体中加入足量的浓盐酸,又收集到b mol Cl2,此时Mn元素全部以Mn2+的形式存在于溶液中。
(1)请根据上述描述写出K2MnO4与浓盐酸反应制氯气的离子反应方程式:__________________。
(2)通过上述文字中提供的数据计算出a+b的范围为_____________________。
Ⅲ. ClO2可替代Cl2作为自来水消毒剂。常用 “有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是:每克含氯消毒剂的氧化能力相当于多少克Cl2的氧化能力。则ClO2的有效氯含量为__________。(计算结果保留两位小数)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com