
科目: 来源: 题型:
【题目】一定温度下,向10 mL 0.40 mol·L-1 H2O2溶液中加入适量FeCl3溶液,不同时刻测得生成O2的体积(已折算为标准状况)如下表所示。
t / min | 0 | 2 | 4 | 6 |
V(O2) / mL | 0 | 9.9 | 17.2 | 22.4 |
资料显示,反应分两步进行:
①2Fe3++ H2O2 ![]() 2Fe2++O2↑+2H+
2Fe2++O2↑+2H+
② H2O2 + 2Fe2++2H+ ![]() 2H2O+2Fe3+
2H2O+2Fe3+
反应过程中能量变化如右图所示。下列说法不正确的是

A. 0~6 min的平均反应速率:v(H2O2) = 3.33×10-2 mol·L-1·min-1
B. Fe3+的作用是加快过氧化氢的分解速率
C. 反应①是吸热反应、反应②是放热反应
D. 反应2H2O2(aq)![]() 2H2O(l) + O2(g)的△H =E1-E2 < 0
2H2O(l) + O2(g)的△H =E1-E2 < 0
查看答案和解析>>
科目: 来源: 题型:
【题目】二氯化二硫(S2Cl2)是广泛用于橡胶工业的硫化剂,其分子结构如图所示.常温下,S2Cl2遇水易与水发生反应,并产生能使品红褪色的气体,下列说法中错误的是( ) 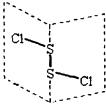
A.S2Cl2的结构式为 Cl﹣S﹣S﹣Cl
B.S2Cl2与水反应时只有S﹣Cl断裂
C.S2Br2含有极性键和非极性键
D.S2Cl2与H2O反应的化学方程式可能为:2S2Cl2+2H2O=SO2↑+3S↓+4HCl
查看答案和解析>>
科目: 来源: 题型:
【题目】某兴趣小组探究SO2气体还原Fe3+、I2,他们使用的药品和装置如下图所示:

FeCl3溶液 /含有淀粉的碘水/NaOH溶液
A B C
(1)SO2气体还原Fe3+的氧化产物是____________(填离子符号),参加该反应的SO2和Fe3+的物质的量之比是____________。
(2)下列实验方案适用于在实验室制取所需SO2的是____________(填序号)。
A.Na2SO3溶液与HNO3 B.Na2SO3固体与浓硫酸
C.固体硫在纯氧中燃烧 D.铜与热浓H2SO4
(3)装置C的作用是_______________________________________。
(4)若要从A中所得溶液提取晶体,必须进行的实验操作步骤:蒸发、冷却结晶、过滤、自然干燥,在这一系列操作中没有用到的仪器有____________(填序号)。
A.蒸发皿 B.石棉网 C.漏斗 D.烧杯 E.玻璃棒 F.坩埚
(5)在上述装置中通入SO2,为了验证A中SO2与Fe3+发生了氧化还原反应,他们取A中的溶液,分成三份,并设计了如下实验:
方案①:往第二份试液加入铁氰化钾溶液,产生蓝色沉淀。
方案②:往第一份试液中加入KMnO4溶液,紫红色褪去。
方案③:往第三份试液加入用稀盐酸酸化的BaCl2,产生白色沉淀。
上述方案不合理的是________,原因是__________________________________。
(6)能表明I-的还原性弱于SO2的化学方程式为__________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】请填写完成下列混合物分离的方法:
(1)除去水中的泥沙________。
(2)分离碘和铁屑________________。
(3)除去水中的植物油________。
(4)从海水中得到淡水________。
查看答案和解析>>
科目: 来源: 题型:
【题目】NH3和纯净的O2在一定条件下发生反应:4NH3(g)+3O2(g)2N2(g)+6H2O(g),现向一容积不变的2L密闭容器中充入4mol NH3和3mol O2 , 4min后,测得生成的H2O占混合气体体积的40%,则下列表示此段时间内该反应的平均速率不正确的是( )
A.v(O2)=0.225 molL﹣1min﹣1
B.v(H2O)=0.375 molL﹣1min﹣1
C.v(N2)=0.125 molL﹣1min﹣1
D.v(NH3)=0.250 molL﹣1min﹣1
查看答案和解析>>
科目: 来源: 题型:
【题目】下列电离方程式书写错误的是( )
A. Ca(OH)2=CaOH++OH-
B. HCl=H++Cl-
C. Ba(NO3)2=Ba2++2NO3-
D. NaOH=Na++OH-
查看答案和解析>>
科目: 来源: 题型:
【题目】理想的“原子经济”是原料分子中的原子全部转变成所需产物,不产生副产物,实现零排放.下列几种生产乙苯的方法中,原子经济性最好的是(反应均在一定条件下进行)( )
A.![]()
B.![]()
C.![]()
D.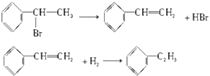
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com