
科目: 来源: 题型:
【题目】三盐基硫酸铅(3PbO·PbSO4·H2O)简称三盐,白色或微黄色粉末,稍带甜味、有毒。200℃以上开始失去结晶水,不溶于水及有机溶剂。可用作聚氯乙烯的热稳定剂。以铅泥(主要成分为PbO、Pb及PbSO4等)为原料制备三盐的工艺流程如下图所示。

已知:常温下PbSO4的溶解度比PbCO3的溶解度大
请回答下列问题:
(1)步骤①转化的目的是____________,滤液1中的溶质为Na2CO3和_________(填化学式)。
(2)步骤③酸溶时,为提高酸溶速率,可采取的措施是___________(任写一条)。其中铅与硝酸反应生成Pb(NO3)2和NO的离子方程式为__________________。
(3)滤液2中可循环利用的溶质为__________(填化学式)。
(4)步骤⑥合成三盐的化学方程式为_______________________________________(已知反应中元素价态不变)。
(5)简述步骤⑦洗涤沉淀的方法__________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】在酸性溶液中,下列各组离子能大量共存的是( )
A.K+、Fe3+、SO ![]() 、NO3﹣
、NO3﹣
B.Cu2+、Mg2+、SO ![]() 、Cl﹣
、Cl﹣
C.Ag+、Na+、NO3﹣、Cl﹣
D.K+、Na+、CO ![]() 、OH﹣
、OH﹣
查看答案和解析>>
科目: 来源: 题型:
【题目】下列除去杂质的方法正确的是( )
物质 | 杂质 | 试剂 | 主要操作 | |
A | NaHCO3固体 | Na2CO3固体 | / | 加热 |
B | SiO2 | Al2O3 | 氢氧化钠溶液 | 过滤 |
C | Cl2 | HCl | 饱和食盐水 | 洗气 |
D | CO2 | HCl | 饱和碳酸钠溶液 | 洗气 |
A. A B. B C. C D. D
查看答案和解析>>
科目: 来源: 题型:
【题目】在盛有稀H2SO4的烧杯中放入用导线连接锌片和铜片,下列叙述正确的是( )
A.正极附近的SO42﹣离子浓度逐渐增大
B.正极有O2逸出
C.电子通过导线由铜片流向锌片
D.铜片上有H2逸出
查看答案和解析>>
科目: 来源: 题型:
【题目】一定条件下发生反应:2X(g)![]() Y(g)+3Z(g) △H=akJ·mol-1(a>0)下列说法正确的是
Y(g)+3Z(g) △H=akJ·mol-1(a>0)下列说法正确的是
A. 增大X的浓度,正反应速率增大,逆反应速率减小
B. 将0.2molX充入反应器中,充分反应后,生成的Z的物质的量可能为0.09mol
C. 达到化学平衡状态时,正、逆反应的速率都为0
D. 达到化学平衡状态时,共吸收a kJ热量
查看答案和解析>>
科目: 来源: 题型:
【题目】硫化碱法是工业上制备Na2S2O3的方法之一,其反应原理为:2Na2S+Na2CO3+4SO2==3Na2S2O3+CO2(该反应△H>0),某研究小组在实验室用硫化碱法制备Na2S2O3·5H2O的流程如下。

(1)吸硫装置如图所示。

①装置B的作用是检验装置A中SO2的吸收效率,B中试剂是 ____________ ,表明SO2吸收效率低的实验现象是B中溶液 _________________。
②为了使SO2尽可能吸收完全,在不改变A中溶液浓度、体积的条件下,除了及时搅拌反应物外,还可采取的合理措施是 __________________ 。(答一条)
(2)假设本实验所用的Na2CO3含少量NaCl、NaOH,设计实验方案进行检验。(室温时CaCO3饱和溶液的pH=10.2)。
序号 | 实验操作 | 预期现象 | 结论 |
① | 取少量样品于试管中,加入适量蒸馏水,充分振荡溶解, _________。 | 有白色沉淀生成 | 样品含NaCl |
② | 另取少量样品于烧杯中,加入适量蒸馏水,充分搅拌溶解,________。 | 有白色沉淀生成,上层清液pH>10.2 | 样品含NaOH |
(3)Na2S2O3溶液是定量实验中的常用试剂,测定其浓度的过程如下:
第一步:准确称取a g KIO3(相对分子质量为214)固体配成溶液;
第二步:加入过量KI固体和H2SO4溶液,滴加指示剂;
第三步: 用Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液的体积为V mL。
则c(Na2S2O3)=_________mol·L-1。
已知:IO3-+5I-+6H+= 3I2+3H2O ,2S2O32-+I2=S4O62-+2I-
(4)某同学第一步和第二步的操作都很规范,第三步滴速太慢,这样测得的Na2S2O3浓度可能__________(填“不受影响”、“偏低”或“偏高”),原因是_________________________________。(用离子方程式表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】一定条件下,CH4与H2O(g)发生反应:CH4(g)+H2O(g) ![]() CO(g)+3H2(g)。 设起始
CO(g)+3H2(g)。 设起始![]() ,在恒压下,平衡时CH4的体积分数
,在恒压下,平衡时CH4的体积分数![]() 与Z和T(温度)的关系如图所示,下列说法错误的是
与Z和T(温度)的关系如图所示,下列说法错误的是
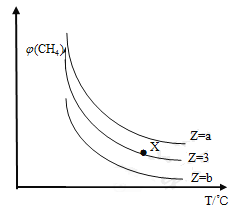
A. 该反应的焓变△H>0
B. 图中Z的大小为b>3>a
C. 图中X点对应的平衡混合物中![]()
D. 温度不变时,加压,平衡逆向移动,甲烷的体积分数增大
查看答案和解析>>
科目: 来源: 题型:
【题目】铁和铜都是日常生活中常见的金属,有着广泛的用途。请回答下列问题:
(1)铁在元素周期表中的位置_________。
(2)配合物Fe(CO)n常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)n晶体属于______(填晶体类型)。Fe(CO)n的中心原子价电子数与配体提供电子数之和为18,则n=______ 。Fe(CO)n在一定条件下发生反应:Fe(CO)n(s)![]() Fe(s)+ n CO(g)。已知反应过程中只断裂配位键,则该反应生成物中新形成的化学键类型为___________。
Fe(s)+ n CO(g)。已知反应过程中只断裂配位键,则该反应生成物中新形成的化学键类型为___________。
(3)K3[Fe(CN)6]溶液可用于检验________(填离子符号)。CN-中碳原子杂化轨道类型为_________,C、N、O三元素的第一电离能由大到小的顺序为_______(用元素符号表示)。
(4)铜晶体的晶胞如右图所示。
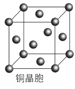
①基态铜原子的核外电子排布式为________________。
②每个铜原子周围距离最近的铜原子数目________。
(5)某M原子的外围电子排布式为3s23p5,铜与M形成化合物的晶胞如附图所示(黑点代表铜原子)。
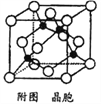
①该晶体的化学式为____________。
②已知该晶体的密度为g.cm-3,阿伏伽德罗常数为NA,则该晶体中铜原子和M原子之间的最短距离为_________pm(只写计算式)。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是( )
A. CH3(C2H5)CHCH(CH3)2的系统命名为2—甲基—3—乙基丁烷
B. 苯甲酸的结构简式为![]()
C. 利用乙醇的还原性以及Cr3+、Cr2O72-的颜色差异来检验酒后驾车
D. C5H10的同分异构体中属于烯烃的有6种
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,向浓度均为 0.1 molL-1、体积均为 100 mL 的两种一元酸 HX、HY的溶液中,分别加入 NaOH固体,lg[c(H+ )/c(OH- )]随加入 NaOH的物质的量的变化如图所示。下列说法正确的是

A. 常温下电离常数:HX < HY![]()
B. a 点由水电离出的 c(H+)=10-12 molL-1
C. c 点溶液中:c(Y- )>c(HY )![]()
D. b 点时酸碱恰好完全中和
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com