
科目: 来源: 题型:
【题目】锡及其化合物在生产、生活中有着重要的用途。已知: Sn的熔点为231℃;Sn2+易水解、易被氧化;SnCl4极易水解、熔点为-33℃、沸点为114℃。请回答下列问题:
(1)元素锡比同主族碳的周期数大3,锡的原子序数为_________。
(2)用于微电子器件生产的锡粉纯度测定(已知锡的相对原子质量为119): ①取1.19g试样溶于稀硫酸中(杂质不参与反应),使Sn 完全转化为Sn2+;②加入过量的Fe2(SO4)3;③用0.1000mol/LK2Cr2O7溶液滴定(产物中Cr呈+3价),消耗20.00mL。步骤②中加入Fe2(SO4)3的作用是________;此锡粉样品中锡的质量分数为_________。若在滴定终点时俯视读数,则会导致测得的样品中锡的质量分数________(填“偏高“偏低”或“无影响”)。
(2)用于镀锡工业的硫酸亚锡(SnSO4)的制备路线如下:

①步骤I加入Sn粉的作用:____________及调节溶液pH。
②步骤II用到的玻璃仪器有烧杯、____________。
③步骤III生成SnO的离子方程式: ____________。
④步骤IV中检验SnO是否洗涤干净的操作是____________,证明已洗净。
⑤步骤V操作依次为____________ 、____________过滤、洗涤、低温干燥。
(4)实验室欲用下图装置制备少量SnCl4(夹持装置略),该装置存在明显缺陷,改进方法是____________。

查看答案和解析>>
科目: 来源: 题型:
【题目】某同学按图所示的装置进行电解实验。下列说法正确的是( )
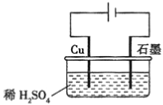
A. 电解过程中,铜极上有H2生成
B. 电解初期,主反应方程式为:2H2O=H2↑+O2↑
C. 整个电解过程中,H+的浓度不断增大
D. 电解一定时间后,石墨电极上有铜析出
查看答案和解析>>
科目: 来源: 题型:
【题目】糖类、油脂、蛋白质都是人体必需的营养物质。
①油脂被摄入人体后.在酶的作用下水解为高级脂肪酸和_____(写名称).进而被氧化生成二氧化碳和水并提供能量,或作为合成人体所需其他物质的原料.
②氨基酸是组成蛋白质的基本结构单元,其分子中一定含有的官能团是氨基(—N H2)和_______(写结构简式).
③淀粉在淀粉酶的作用下最终水解为葡萄糖(C6H12O6 ),写出相应的化学方程式:___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】将一定质量的Na2CO3和NaHCO3的固体混合物充分加热至恒重,共收集到CO2为2.24L。充分冷却后,向残留的固体中逐滴加入稀盐酸至没有气体放出为止,恰好用去稀盐酸100mL,又收集到CO2为4.48L(假设气体的体积均在标准状况下测定;反应后溶液的体积仍为100mL)。试计算:
⑴原固体混合物中Na2CO3与NaHCO3的物质的量之比为_____________________
⑵反应后的溶液中溶质的物质的量浓度为______________________________
查看答案和解析>>
科目: 来源: 题型:
【题目】查阅资料发现,金属钠不仅能跟氧气和水反应,还能跟多种其他物质发生反应,其中包括与酒精在常温下反应。要研究金属钠跟酒精反应的性质,以及金属钠跟水反应的异同点,下列研究方法中没有用到的是
A. 实验法 B. 观察法 C. 分类法 D. 比较法
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学兴趣小组想从FeI2溶液中获得碘单质,其设计流程如图。
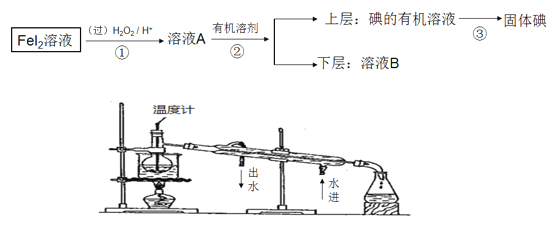
请回答:
(1)操作②中除烧杯外,还要用到的玻璃仪器的名称是________________
(2)有同学试图利用蒸馏方法来实现第③步操作,该同学设计了如图的实验装置,此装置中的明显错误是___________________________________
(3)溶液B呈黄色,除了含Fe3+,可能还含有I2,请你设计一个实验方案加以证明,你的实验操作方案是__________________________________________
查看答案和解析>>
科目: 来源: 题型:
【题目】在三个容积均为2L的密闭容器中发生反应:2HI(g)H2(g)+I2(g),已知H2(g)和I2(g)的起始物质的量均为0,HI(g)的物质的量随反应时间和温度的变化情况如表所示:
序号 | 时间/min | 0 | 10 | 20 | 30 | 40 | 50 |
1 | 800 | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 |
2 | 800 | 1.0 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 |
3 | 820 | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 |
(1)实验1和实验2中使用了催化剂的实验是(填“1”或“2”);
(2)实验1中,0l0min内生成H2的平均反应速率为molL﹣1min﹣1;
(3)实验3的反应达到化学反应限度时,HI(g)转化率为 .
查看答案和解析>>
科目: 来源: 题型:
【题目】燃料电池是一种能量转换效率高、对环境友好的化学电源,图为一种氢氧燃料电池的结构装置. 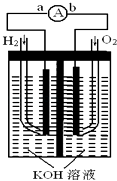
(1)电极b为该燃料电池的极(填“正”或“负”),电极方程式为;
(2)电池工作时,溶液中的OH﹣移向极(填“a”或“b”);
(3)电池工作时,在导线中电子流动方向为(用a、b表示);
(4)电池使用一段时间后,溶液的pH值(填“增大”或“减小”);
(5)当电池工作一段时间后消耗标准状况下H2为6.72L时,转移电子mol.
查看答案和解析>>
科目: 来源: 题型:
【题目】下列是部分短周期中第二、第三周期元素的原子半径及主要化合价.
元素代号 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
原子半径(nm) | 0.186 | 0.160 | 0.152 | 0.143 | 0.110 | 0.099 | 0.075 | 0.074 |
主要化合价 | +1 | +2 | +1 | +3 | +5、﹣3 | +7、﹣1 | +5、﹣3 | ﹣2 |
回答下列问题:
(1)⑧在元素周期表中的位置是(周期、族);
(2)8个元素的最高价氧化物的水化物中,酸性最强的是(填化学式);
(3)元素⑤、⑦、⑧分别形成的简单气态氢化物中,⑦的电子式为 , 稳定性最强的氢化物的结构式为;
(4)写出①、④的最高价氧化物对应的水化物之间发生反应的离子方程式;
(5)用电子式表示元素①与⑥形成化合物的过程 .
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,将等体积,等物质的量浓度的NH4HCO3与NaCl溶液混合,析出部分NaHCO3晶体,过滤,所得滤液pH<7。下列关于滤液中的离子浓度关系不正确的是
A.  <1.0×10-7mol/L
<1.0×10-7mol/L
B. c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3)
C. c(H+)+c(NH4+)=c(OH-)+c(HCO3-)+2c(CO32-)
D. c(Cl-)>c(NH4+)>c(HCO3-)>c(CO32-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com