
科目: 来源: 题型:
【题目】在密闭容器中一定量混合气体发生反应:xA(g)+yB(g) ![]() zC(g)平衡时测得A的浓度为0.5 mol·L-1,保持温度不变,将容器的容积扩大到原来的2倍,再达平衡时测得A的浓度为0.2 mol·L-1,下列判断正确的是( )
zC(g)平衡时测得A的浓度为0.5 mol·L-1,保持温度不变,将容器的容积扩大到原来的2倍,再达平衡时测得A的浓度为0.2 mol·L-1,下列判断正确的是( )
A. 平衡向正反应方向移动 B. x+y>z
C. C的体积分数保持不变 D. B的转化率降低
查看答案和解析>>
科目: 来源: 题型:
【题目】将32.64g铜与140mL一定浓度的硝酸反应,铜完全溶解产生的NO和NO2混合气体在标准状况下的体积为11.2L。请回答:
(1)NO的物质的量为_______mol,NO2的物质的量为________mol。
(2)待产生的气体全部释放后,向溶液加入VmL、amolL-1的NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,则原硝酸溶液的浓度为_______mol/L。
(3)欲使铜与硝酸反应生成的气体在NaOH溶液中企部转化为NaNO3,至少需耍30%的双氧水______g。
查看答案和解析>>
科目: 来源: 题型:
【题目】“绿色化学”的核心是实现污染物“零排放”。下列最符合“绿色化学”理念的是
A. 利用太阳能分解水制氢气
B. 在厂区大量植树绿化,净化污染的空气
C. 将煤液化后使用以提高煤的利用率
D. 将化石燃料充分燃烧后再排放
查看答案和解析>>
科目: 来源: 题型:
【题目】含氮的化合物广泛存在于自然界,是一类非常重要的化合物。回答下列问题:
(1)在一定条件下:2N2(g)+6H2O(g)=4NH3(g)+3O2(g)。己知该反应的相关的化学键键能数据如下:
化学键 | N≡N | H-O | N-H | O=O |
E/(kJ/mol) | 946 | 463 | 391 | 496 |
则该反应的△H=________kJ/mol.
(2)在恒容密闭容器中充入2molNO2与1molO2发生反应如下:4NO2(g)+O2(g)![]() 2N2O5(g)
2N2O5(g)
①已知在不同温度下测得N2O5的物质的量随时间的变化如图1所示。“高温下,该反应能逆向自发进行,原因是___________________________。

②下列有关该反应的说法正确的是________。
A.扩大容器体积,平衡向逆反应方向移动,混合气体颜色变深
B.恒温恒容,再充入2molNO2和1molO2,再次达到平衡时NO2转化率增大
C.恒温恒容,当容器内的密度不再改变,则反应达到平衡状态
D.若该反应的平衡常数增大,则一定是降低了温度
(3)N2O5是一种新型绿色硝化剂,其制备可以用硼氢化钠燃料电池作电源,采用电解法制备得到N2O5,工作原理如图。则砌氢化钠燃料电池的负极反应式为___________。

(4)X、Y、Z、W分别是HNO3、NH4NO3、NaOH、NaNO2四种强电解质中的一种。上表是常温下浓度均为0.01mol/L的X、Y、Z、W溶液的pH。将X、Y、Z各1mol同时溶于水中得到混合溶液,则混合溶液中各离子的浓度由大到小的顺序为________________。
(5)氮的氧化物与悬浮在大气中的海盐粒子相互作用时,涉及如下反应:
I:2NO2(g)+NaCl(s)![]() NaNO3(s)+ClNO(g) K1
NaNO3(s)+ClNO(g) K1
II:2NO(g)+Cl2(g)![]() 2ClNO(g) K2
2ClNO(g) K2
①4NO(g)+2NaCl(s) ![]() 2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=_____(用K1、K2表示);
2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=_____(用K1、K2表示);
②在恒温条件下,向2L恒容密闭容器中加入0.2molNO和0.1molCl2,10min时反应II达到平衡。测得10min内v(ClNO)=7.5×10-3mol/(L·min),则平衡时NO的转化率α1=_____;其他条件不变,反应II在恒压条件下进行,平衡时NO的转化率α2___α1 (填“>”“<”或“=”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】从海水中可以获得淡水、食盐并可提取镁和溴等物质.
(1)海水淡化的方法主要有(填一种);
(2)下列物质不需要经过化学变化就能从海水中获得的物质是 (填序号);
A.液溴
B.食盐
C.氢气
D.淡水
(3)从海水中提取溴和镁的流程如下: 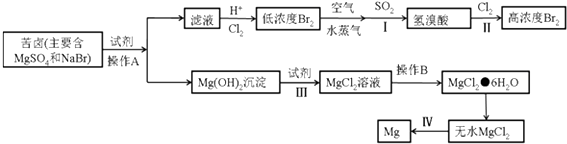
①写出下列步骤的离子方程式或化学方程式
步骤I的化学方程式: ,
步骤III的离子方程式: ,
步骤IV的化学方程式: .
②操作A是 , 操作B是 , 从步骤II得到的溶液中提取溴还需要进行的操作有:、萃取、蒸馏.
查看答案和解析>>
科目: 来源: 题型:
【题目】在理论上可用于设计原电池的化学反应是 ( )
A. 2Al(s)十2NaOH(aq)+2H2O(1)=2NaAlO2(ag)+3H2(g);△H <0
B. Ba(OH)2·8H2O(s)+2NH4Cl(s)=BaCl2(aq)+2NH3·H2O(aq)+8H2O(1);△H >0
C. CaC2(s)+2H2O(1)→Ca(OH)2(s)+C2H2(g);△H <0
D. FeCl3(aq)十3H2O(1) ![]() Fe(OH)3(s)+3HCl(aq);△H >0
Fe(OH)3(s)+3HCl(aq);△H >0
查看答案和解析>>
科目: 来源: 题型:
【题目】在碱性溶液中能大量共存且为无色透明溶液的是
A. K+、Cl-、MnO4-、SO42- B. Na+、SO42-、Cl-、NO3-
C. H+、NO3-、SO42-、Mg2+ D. Na+、Cu2+、NO3-、CO32-
查看答案和解析>>
科目: 来源: 题型:
【题目】1869年,俄国化学家门捷列夫制作出了第一张元素周期表,成为化学史上的重要里程碑之一。下列说法中,不正确的是
A. 元素周期表有七个周期
B. 元素周期表有7个主族,7个副族
C. 氧元素位于第二周期ⅥA族
D. 稀有气体元素原子的最外层电子数均为8个
查看答案和解析>>
科目: 来源: 题型:
【题目】工业合成氨的反应是在500 ℃左右进行,主要原因是( )
A.500 ℃时反应速率最快
B.500 ℃时的平衡浓度最大
C.500 ℃时的转化率最高
D.500 ℃催化剂能发挥最大效力
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com