
科目: 来源: 题型:
【题目】下列说法不正确的是
A.铜片在稀硫酸和NaNO3混合溶液中可溶解
B.常温常压下,46gNO2和N2O4混合气体共含有3mol原子
C.光纤通讯中制造光纤的基本原料是SiO2
D.光照氯水有气泡,逸出该气体是Cl2
查看答案和解析>>
科目: 来源: 题型:
【题目】氯化硫(S2Cl2)是一种黄红色液体,有刺激性、窒息性恶臭,熔点为﹣80℃,沸点137.1℃.在空气中强烈发烟,易与水发生反应.人们使用它作橡胶硫化剂使橡胶硫化,改变生橡胶受热发粘遇冷变硬的不良性能.在熔融的硫中通入氯气即可生成S2Cl2 . 下图是实验室用S和Cl2制备S2Cl2的装置(夹持装置、加热装置均已略去). 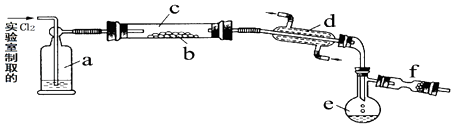
(1)已知S2Cl2分子结构与H2O2相似,请写出S2Cl2的电子式 .
(2)装置a中应放试剂为 , 其作用为 .
(3)该实验的操作顺序应为:②﹣(用序号表示). ①加热装置c ②通入Cl2③通冷凝水 ④停止通Cl2⑤停止加热装置c
(4)f装置中应放置的试剂为 , 其作用为 .
(5)已知S2Cl2与H2O反应时,只有一种元素的化合价发生了变化,且被氧化和被还原的该元素的物质的量之比为1:3,请写出该反应的化学方程式 .
查看答案和解析>>
科目: 来源: 题型:
【题目】一定条件下,在容积为1 L的密闭容器中发生可逆反应:Fe(s)+H2O(g) ![]() FeO(s)+H2(g) ΔH>0。在1 000℃时,H2O(g)的平衡转化率(α)与体系总压强(p)关系如图所示。
FeO(s)+H2(g) ΔH>0。在1 000℃时,H2O(g)的平衡转化率(α)与体系总压强(p)关系如图所示。
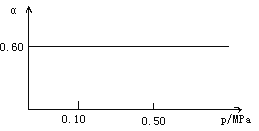
(1)写出该反应的平衡常数表达式K=__________。当反应达到平衡后,再向容器中加入铁粉和水蒸气,则K__________,(填“增大”、“减小”或“不变”,下同);升高温度,则K__________。
(2)在1 000℃时,若向上述容器中加入0.80 mol铁粉和1.00 mol水蒸气,达到平衡时,容器中c(H2)=______。
查看答案和解析>>
科目: 来源: 题型:
【题目】NA为阿伏伽德罗常数的值,下列说法正确的是( )
A.1L 0.1mol/L的氨水中有0.1NA个NH4+
B.17 g H2O2中含有8NA个电子
C.7.8g Na2S和7.8g Na2O2所含离子数相等,均为0.3 NA
D.标准状况下,22.4LNO与11.2LO2混合后气体的分子数为NA
查看答案和解析>>
科目: 来源: 题型:
【题目】下列各种叙述中正确的是( )
A. 在任何条件下,纯水的pH=7 B. 在任何条件下,纯水都呈中性
C. 在90℃时,纯水中pH=7 D. 在50℃时,纯水c(H+)<10-7mol/L
查看答案和解析>>
科目: 来源: 题型:
【题目】已知: Mg能在NO2中燃烧,可能产物为Mg3N2、MgO和N2。Mg3N2容易与水反应。
(1) 某实验探究小组探究Mg与NO2反应的固体产物成分,对固体产物提出三种假设:
I.假设为: 固体产物为MgO;II.假设为:________;III.假设为: ________。
(2) 该小组通过如下实验装置来验证Mg在NO2中燃烧反应产物(夹持装置省略,部分仪器可重复使用
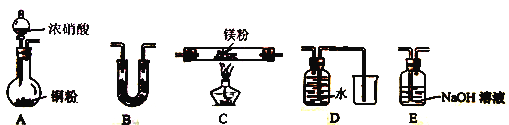
①实验装置连接的顺序为____________(填字母序号);
②装置B中盛装的试剂可以是_______ (填字母)
a.浓硫酸 b.碱石灰 c.无水CaCl2 d.五氧化二磷
③确定产物中有N2生成的实验现象为_____________________。
(3)设计实验证明: 产物中存在Mg3N2: ____________________。
(4)己知装置C中初始加入Mg粉质量为13.2g,在足量的NO2中充分燃烧,实验结束后,硬质玻璃管冷却至室温、称量,测得硬质玻璃管中剩余固体的质量为21.0g,产生N2的体积为1120mL(标准状况)。写出玻璃管中发生反应的化学方程式:_________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】X、Y、Z、W四种主族元素,它们在周期表中位置如图所示,下列说法正确的是
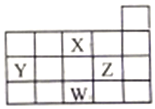
A. X、Y、Z三种元素的原子半径依次增大 B. X元素的氢化物稳定性比Y元素的弱
C. 化合物YZ4和氨气反应可以生成Y单项 D. 氢化物沸点: W>X
查看答案和解析>>
科目: 来源: 题型:
【题目】煤矿的矿井里为了防止“瓦斯”(甲烷)爆炸事故,应采取的安全措施是( )
A.通风并严禁烟火
B.进矿井前先用明火检查是否有甲烷
C.戴防毒面具
D.用大量水吸收甲烷
查看答案和解析>>
科目: 来源: 题型:
【题目】H2S 是一种大气污染物,工业上采取多种方法减少它的排放。
(1)工业上可采取生物脱H2S 方法减少H2S 的排放。生物脱H2S 的原理为:H2S + Fe2(SO4)3= S↓+ 2FeSO4 + H2SO4 4FeSO4 +O2 +2H2SO4 ![]() 2Fe2(SO4)3+2H2O
2Fe2(SO4)3+2H2O
试回答下列问题:
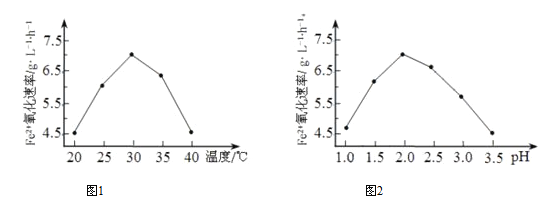
①硫杆菌存在时,FeSO4被氧化的速率是无菌时5.0×105倍,该菌的作用是_________。
②由下图1和图2 判断使用硫杆菌的最佳条件为_________。若反应温度过高,反应速率下降,其原因是____________。
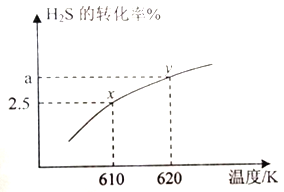
(2) 羰基硫(COS) 常在石化工业中用作在线仪表的校正气、标准气。其制备方法之一是H2S 与COS 在高温下发生反应: H2S(g)+CO2(g)![]() COS(g)+H2O(g) 在610K 时,将0.40mol H2S 与0.10molCO2充入2.5 L 的空钢瓶中,H2S的平衡转化率与温度的关系如图所示:
COS(g)+H2O(g) 在610K 时,将0.40mol H2S 与0.10molCO2充入2.5 L 的空钢瓶中,H2S的平衡转化率与温度的关系如图所示:
①下列说法能表明反应已达平衡状态的是__________。
A.H2S 和CO2的物质的量之比保持不变 B.混合气体的密度保持不变
C.混合气体的平均相对分子质量不再变化D.v逆(H2S)=V正(COS)
②该反应的△H______0.(填“>”“<”或“=”);x点对应温度下反应的平衡常数K=_____(保留两位有效数字)。
③在620K重复试验,若平衡后水的物质的量分数为0.030.则H2S 的转化率a=_____%。
查看答案和解析>>
科目: 来源: 题型:
【题目】对 ![]() X与
X与 ![]() X+两种微粒,下列叙述正确的是( )
X+两种微粒,下列叙述正确的是( )
A.一定都是由质子、中子、电子组成的
B.质子数一定相同,质量数和中子数一定不相同
C.核电荷数和核外电子数一定相等
D.化学性质几乎完全相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com