
科目: 来源: 题型:
【题目】在一定温度下,对于可逆反应:A(s)+2B(g) ![]() C(g)+2D(g) ΔH > 0,则下列叙述正确的是( )
C(g)+2D(g) ΔH > 0,则下列叙述正确的是( )
A. 其他条件不变时,增加A的量平衡向正向进行
B. 该反应的平衡常数表达式为: ![]()
C. 升高温度时,该反应的平衡常数增大
D. 减小反应物A的浓度,该反应的平衡常数减小
查看答案和解析>>
科目: 来源: 题型:
【题目】将标准状况下体积为2.24L的H2S缓慢通入100ml,1.5mol/L NaOH溶液中(溶液体积变化忽略不计),充分反应后,下列关系不正确的是( )
A. c(Na+)+c(H+)=c(HS-)+2 c(S2-)+c(OH-) B. 2c(Na+)=3[c(HS-)+c(S2-)+c(H2S)]
C. c(Na+)>c(HS-)>c(S2-)>c(H+)>c(OH-) D. c(HS-)+c(S2-)+c(H2S)=1.0 mol/L
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:①甲醛(HCHO)与葡萄糖化学性质相似,都具有还原性。②甲酸钙易溶于水。为探究过量甲醛和新制Cu(OH)2反应的产物,进行如下实验。
(1)在右图装置中进行实验,向a中加入0.5 mol·L-1CuSO4溶液50 mL和5 mol·L-1NaOH溶液100 mL,振荡,再加入40%的甲醛溶液50 mL,缓慢加热20分钟后冷却至室温。
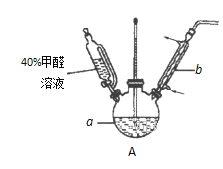
①仪器a的名称是_____________;
②能说明甲醛具有还原性的实验现象是______________。
(2)上述实验有副反应发生,产生的气体为CO、H2中的一种或两种。为确认气体成分,将装置A和如下图所示装置连接后进行实验。
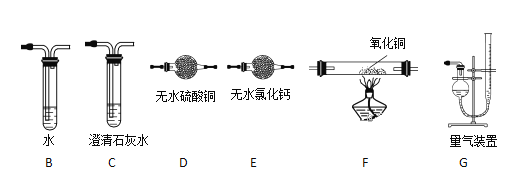
依次连接的合理顺序为A→B→___→____→____→____→G,装置B的作用是_________。有H2的实验现象是_________________________。
(3)已知HCHO![]() HCOOH
HCOOH![]() H2CO3。设计实验证明a中甲醛中的碳元素未被氧化成+4价。写出实验操作、现象、结论______________________。
H2CO3。设计实验证明a中甲醛中的碳元素未被氧化成+4价。写出实验操作、现象、结论______________________。
(4)反应后a中有红色固体产生,为探究其组成,提出如下假设:
假设一:只有Cu2O。 假设二:只有Cu。
假设三:Cu2O和CuO 假设四:________________________ ;
假设_______明显不成立,理由是___________________________ 。
进行如下实验(以下每步均充分反应):

已知:Cu2O ![]() [Cu(NH3)4]+(无色)
[Cu(NH3)4]+(无色)![]() [Cu(NH3)4]2+(蓝色)
[Cu(NH3)4]2+(蓝色)
①锥形瓶ii中固体完全溶解得深蓝色溶液的离子方程式为____________________;
②将容量瓶ii中的溶液稀释100倍后,溶液的颜色与容量瓶i相近。由此可知固体产物的组成及物质的量之比约为________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是( )
A. 常温下醋酸分子不可能存在于pH>7的碱性溶液中
B. 0.1 mol·L-1碳酸氢钠溶液中离子浓度关系是:c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3)
C. 常温下向氯化铵溶液中加入少量氨水使溶液的pH=7,则混合溶液中:c(Cl-)>c(NH![]() )
)
D. 0.1 mol·L-1氯化铵溶液与0.1 mol·L-1的氢氧化钠溶液等体积混合溶液中的离子浓度为:c(Cl-) > c(Na+) > c(NH![]() ) > c(OH-)
) > c(OH-)
查看答案和解析>>
科目: 来源: 题型:
【题目】下列叙述正确的是( )
A. 化学键存在所有单质和化合物中
B. 化学键的断裂和形成是化学反应能量变化的主要原因
C. 只要有能量变化,则一定发生了化学反应
D. 当反应物的总能量低于生成物的总能量时,该反应放出能量
查看答案和解析>>
科目: 来源: 题型:
【题目】下列叙述正确的是( )
A. 95 ℃纯水的pH<7,说明加热可导致水呈酸性
B. pH=3的盐酸溶液,加水稀释至溶液体积为原来体积10倍后pH=4
C. pH=1的盐酸与等体积pH=3的盐酸混合后pH=2
D. pH=3的醋酸溶液与pH=11的氢氧化钠溶液等体积混合后pH=7
查看答案和解析>>
科目: 来源: 题型:
【题目】向含Fe2+、I-、Br-的溶液中通入过量的氯气,溶液中四种粒子的物质的量变化如图所示,已知b-a=5,线段Ⅳ表示一种含氧酸,且Ⅰ和Ⅳ表示的物质中含有相同的元素。下列说法正确的是( )
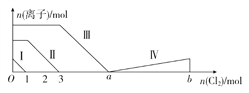
A. 线段Ⅱ表示Br-的变化情况 B. 线段Ⅳ表示IO3-的变化情况
C. 根据图象无法计算a的值 D. 原溶液中n(FeI2)∶n(FeBr2)=3∶1
查看答案和解析>>
科目: 来源: 题型:
【题目】一种回收并利用含碘(I-)废液的工艺流程如下:

(1)“沉淀”中生成CuI的离子方程式为___________________。
(2)CuSO4的投加量对废水中I-的去除量影响较大,不同投加量(用过量系数表示)下,反应后I-和Cu2+的浓度如图所示,则适宜的CuSO4过量系数应为_____,分析原因___________。

(3)反应Ⅰ中生成铁与碘的化合物(其中铁与碘的质量比为21:127),则加入的水的作用是__________,反应Ⅱ的化学方程式是_____________________________。
(4)操作Ⅰ包括______,冰水洗涤的目的是________。
查看答案和解析>>
科目: 来源: 题型:
【题目】对于工农业生产和日常生活中与化学有关的问题,下列认识不正确的是
A.含有氯化钠融雪剂的使用会加快桥梁的腐蚀
B.铝合金的大量使用是因为人们能用焦炭等还原剂从氧化铝中获取铝
C.光缆在信息产业中有广泛应用,制造光缆的主要材料是二氧化硅
D.高温结构陶瓷氮化硅(Si3N4)具有较高的硬度和耐磨性,可用于制造汽车发动机
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com