
科目: 来源: 题型:
【题目】酸雨被称为“天堂的眼泪”,会造成水土酸性化、建筑物加速腐蚀等危害。下列有关说法正确的是
A. 酸雨是指pH值<7的雨水,酸雨长时间放置,酸性变强
B. NO2与SO2的过度排放是形成酸雨的主要原因
C. 使用新型能源不会对酸雨的防治产生效果
D. 酸雨不会对动物的健康产生任何影响
查看答案和解析>>
科目: 来源: 题型:
【题目】图1表示酶和催化剂改变化学反应速率的原理,图2表示加入抑制剂对起始反应速率的影响。酶的抑制剂是与酶结合并降低酶活性的分子。竞争性抑制剂与底物竞争酶的活性部位,非竞争性抑制剂和酶活性部位以外的其他位点结合,从而抑制酶的活性。请回答下列问题。
 图1
图1 图2
图2
(1)由图1可知,该酶降低的活化能是______(用图中字母表示),与无机催化剂相比______________________,因而催化效率更高。
(2)活细胞产生酶的场所有________,需要的原料是________。
(3)图2中对照组是____曲线的结果,其中b为加入_____抑制剂的曲线,判断理由是_________________。请在图2中画出加入该酶的激活剂的曲线。________________
(4)信号肽假说认为,编码分泌蛋白的mRNA在翻译时首先合成的是N末端带有疏水氨基酸残基的信号肽,它被内质网膜上的受体识别并与之相结合。信号肽经由膜中蛋白质形成的孔道到达内质网内腔,但蛋白质转到高尔基体加工时却没有了该信号肽序列。据此我们可以推断内质网中可能存在的酶及作用是_______________。
(5)蛙的红细胞合成酶所需要的ATP主要由_______(过程)产生。
查看答案和解析>>
科目: 来源: 题型:
【题目】偶氮苯是橙红色晶体,溶于乙醇,微溶于水,实验室制取反式偶氮苯的步骤如下:
步骤一:在反应器中加入一定量的硝基苯、甲醇和一小粒碘,装上冷凝管,加入少量镁粉,立即发生反应。等大部分镁粉反应完全后,再加入镁粉,反应继续进行,等镁粉完全反应后,加热回流30 min。
步骤二:将所得液体趁热倒入冰水中,并不断搅拌,用冰醋酸小心中和至pH 为4~5,析出橙红色固体,过滤,用少量冰水洗涤。
步骤三:用95%的乙醇重结晶。
(1)步骤一中反应不需要加热就能剧烈进行,原因是____________。镁粉分两次加入的原因是______________。
(2)步骤二中析出固体用冰水洗涤的原因是______________。若要回收甲醇,实验所需的玻璃仪器除冷凝管、酒精灯、牛角管和锥形瓶外还应有___________。
(3)取0.1g偶氦苯,溶于5 mL左右的苯中,将溶液分成两等份,分别装于两个试管中,其中一个试管用黑纸包好放在阴暗处,另一个则放在阳光下照射。用毛细管各取上述两试管中的溶液点在距离滤纸条末端1cm处,再将滤纸条末端浸入裝有1: 3 的苯-环己烷溶液的容器中,实验操作及现象如图所示。
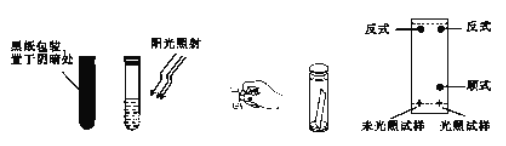
①实验中分离物质所采用的方法是_______法。
②由实验结果可知:_______;利用该方法可以提纯反式偶氮苯。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图表示工业SO2催化氧化反应过程中的速率(v)与时间(t)的关系曲线,下列叙述正确的是( )

A. t2-t3,气体总物质的量保持不变(已知该条件下SO3为气体)
B. t2时,v(SO2)正和v(O2)逆相等且等于0
C. t1时刻,只有正方向的反应没有逆方向的反应
D. t2-t3,处于静止状态,反应不再发生
查看答案和解析>>
科目: 来源: 题型:
【题目】BaCl2溶液中通入SO2气体,没有沉淀生成。再通入或加入某物质后,有沉淀生成,则该物质不可能为
A. HCl B. NO2 C. NH3 D. FeC13
查看答案和解析>>
科目: 来源: 题型:
【题目】除去空气中的二氧化硫和氨氧化物气体对环境保护有重要意义。
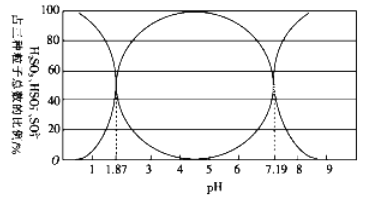
(1)二氧化硫易溶于水,溶于水后所得溶液中H2SO3、HSO3-和SO32- 占三种粒子总数的比例随pH的变化如下图所示。由图可知H2SO3 的电离平衡常数Ka1=____________。
(2)利用尿素[CO(NH2)2]水解的溶液可以吸收含SO2 的空气。已知尿素水解放热,常温下水解反应较慢,水解的反应方程式如下:CO(NH2)2+H2O=H2NCOONH4(氨基甲酸铵)。
①氨基甲酸铵会与空气中的SO2 和O2 反应生成(NH4)2SO4,该反应的化学方程式为__________。
②一定条件下,用尿素溶液吸收含SO2 的空气,测得SO2 的吸收率随溶液的温度变化如图甲所示。温度高于60 ℃时,SO2 的吸收率逐渐升高的原因是_____________。
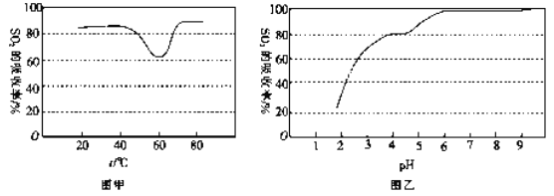
③尿素溶液吸收SO2 的吸收率随溶液的pH变化如图乙所示。尿素溶液吸收含SO2的空气后溶液的pH会降低,为提高SO2 的吸收率和充分回收产物,最好向溶液中加入_____(填溶液的名称)并控制pH 为_______。
(3)一种电化学脱硝法的原理如图所示。
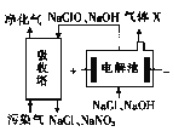
①电解池阴极所发生的电极反应为_____________。
②相同条件下通入的污染气和生成的X 的体积比为40 :3,污染气中NO 和NO2 占总体积的10%,若NaClO完全反应,污染气中NO和NO2 被完全吸收且其余气体不参与反应,则NO和NO2 的体积比为________。
查看答案和解析>>
科目: 来源: 题型:
【题目】在5L的密闭容器中,一定条件下发生化学反应:2NO(g)+2CO(g)N2(g)+2CO2(g).起始反应时NO和CO各为3mol,保持密闭容器体积不变,10秒钟达到化学平衡,测得N2为1mol.下列有关反应速率的说法中,正确的是( )
A.达到平衡后,若将容器体积压缩为2 L,则正反应速率将增大,逆反应速率将减小
B.反应前5秒钟内,用CO表示的平均反应速率为0.04 molL﹣1s﹣1
C.当v正(CO)=2v逆(N2)时,该反应中NO的物质的量不再改变
D.保持压强不变,往容器中充入1 mol He,正、逆反应速率都不改变
查看答案和解析>>
科目: 来源: 题型:
【题目】某兴趣小组用碱式碳酸铜[CuCO3·Cu(OH)2]制取铜粉并测定铜粉纯度的实验如下:
步骤1:将一定量的碱式碳酸铜置于烧杯中,向烧杯中加入N2H4的水溶液,边搅拌边加热,有大量的气体生成和红色铜析出,将沉淀过滤、低温干燥得红色粉末。
步骤2:称取1.9600 g红色粉末于烧杯中,缓慢加入足量稀硫酸,边加热边通入氧气使粉末完全溶解。冷却,将溶液移入100 mL 容量瓶中,用水稀释至刻度。
书骤3:准确量取20.00mL的溶液,调节溶液呈弱酸性,向其中加入过量的KI.,充分反应后,以淀粉溶液作指示剂,用0.2000mol/LNa2S2O3标准溶液滴定,滴定终点时共消耗Na2S2O3标准溶液30.00 mL.过程中所发生的反应如下:Cu2++I-![]() CuI↓+I3-(未配平),I3-+S2O32-=S4O62-+I-(未配平)。
CuI↓+I3-(未配平),I3-+S2O32-=S4O62-+I-(未配平)。
(1)步骤1中所发生反应的化学方程式为_________________。
(2)步骤2 中所发生反应的离子方程式为_________________。
(3)步骤3 中加入过量KI的作用是_________________。
(4)若铜粉中杂质不参与步骤3 的反应,通过计算确定红色粉末中含铜质量分数(写出计算过程)________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的是
A. 氯水中有平衡:Cl2+H2O![]() HCl+HClO,当加入AgNO3溶液后,溶液颜色变浅
HCl+HClO,当加入AgNO3溶液后,溶液颜色变浅
B. 对CO(g)+NO2(g)![]() CO2(g)+NO(g),平衡体系增大压强可使颜色变深
CO2(g)+NO(g),平衡体系增大压强可使颜色变深
C. 对2NO2(g)![]() N2O4(g) △H<0, 升高温度平衡体系颜色变深
N2O4(g) △H<0, 升高温度平衡体系颜色变深
D. SO2催化氧化成SO3的反应,往往加入过量的空气
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com