
科目: 来源: 题型:
【题目】下列说法正确的是
A.煤的液化、气化是物理变化,煤的干馏是化学变化
B.蛋白质、淀粉、纤维素、油脂均属于高分子化合物
C.乙酸乙酯在碱性条件下的水解反应属于皂化反应
D.石油裂化的目的是为了提高汽油等轻质液态油的产量和质量
查看答案和解析>>
科目: 来源: 题型:
【题目】铁、铜单质及其化合物应用范围很广.现有含氯化亚铁杂质的氯化铜晶体(CuCl22H20),为制取纯净的CuCl22H20,首先将其制成水溶液,然后按如图步骤进行提纯: 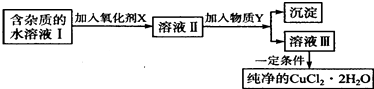
已知Cu2+、Fe3+和Fe2+的氢氧化物开始沉淀和沉淀完全时的pH,见表:
Fe3+ | Fe2+ | Cu2+ | |
氢氧化物开始沉淀时的PH | 1.9 | 7.0 | 4.7 |
氢氧化物完全沉淀时的PH | 3.2 | 9.0 | 6.7 |
请回答下列问题.
(1)最适合作氧化剂X的是 .
A.K2Cr207
B.NaCl0
C.H202
D.KMn04
(2)加入的物质Y是 .
A.CuO
B.NaOH
C.Cu2(OH)2CO3
D.NH3
(3)由溶液Ⅲ获得CuCl22H2O,需要经过、、过滤操作.
(4)测定溶液Ⅰ中Fe2+的浓度,可用KMnO4标准溶液滴定,取用KMnO4溶液应使用(“酸式”或“碱式”)滴定管.反应的化学方程式: .
查看答案和解析>>
科目: 来源: 题型:
【题目】化学与科技、社会、环境密切相关,下列说法中不正确的是( )
A.单晶硅常用于制光导纤维
B.可用醋酸除去水瓶中的水垢
C.开发氢能源汽车,可减少PM2.5的排放
D.工业合成氨属于人工固氮
查看答案和解析>>
科目: 来源: 题型:
【题目】1000mL某待测液中除含有0.2molL﹣1的Na+外,还可能含有下列离子中的一种或多种:
阳离子 | K+、NH4+、Fe3+、Ba2+ |
阴离子 | Cl﹣、Br﹣、CO32﹣、HCO3﹣、SO32﹣、SO42﹣ |
现进行如下实验操作(所加试剂均过量):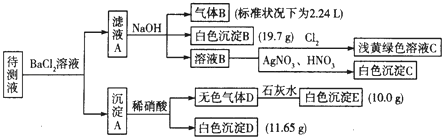
(1)写出生成白色沉淀B的离子方程式: .
(2)若无色气体D是单一气体: ①将阴离子的物质的量浓度填入下表中(一定不存在的填“0”,不能确定的填“?”):
阴离子 | Cl﹣ | Br﹣ | CO32﹣ | HCO3﹣ | SO32﹣ | SO42﹣ |
浓度/molL﹣1 |
②判断原溶液中K+是否存在,若存在,求其物质的量浓度的最小值,若不存在,请说明理由: .
(3)若无色气体D是混合气体,待测液中一定含有的阴离子是 .
查看答案和解析>>
科目: 来源: 题型:
【题目】氢氟酸能腐蚀玻璃。25℃下,向20mL0.2molL-1的氢氟酸中滴加0.2molL-1的NaOH溶液时,溶液的pH变化如图所示。

已知:电离度(α)和电离平衡常数(K)一样,可以用来衡量弱电解质在稀溶液中的电离能力。![]()
请回答下列问题:
(1)在氢氟酸的稀溶液中,通过改变以下条件能使氢氟酸的电离度[![]() (HF)]增大的是_______,可使氢氟酸的电离平衡常数[Ka(HF)] 增大的是_____________。
(HF)]增大的是_______,可使氢氟酸的电离平衡常数[Ka(HF)] 增大的是_____________。
a.升高温度 b.向溶液中滴入2滴浓盐酸 c.加入少量NaF固体 d.加水
(2)在此温度下,氢氟酸的电离平衡常数Ka(HF)为:_____,电离度α(HF)为______%。
(3)下列有关图中各点微粒浓度关系正确的是________。
a.在A处溶液中:c(F—)+c(HF)=0.2 molL-1
b.在B处溶液中:c(H+)+c(HF)= c(OH—)
c.在B处溶液中:c(Na+)>c(F—)>c(H+)>c(OH—)
d.在A和B处溶液中都符合:![]() = Ka(HF)
= Ka(HF)
(4)向此氢氟酸溶液中滴加10mlNaOH溶液后,请将HF分子与溶液中的离子浓度一起从大到小排序 ___________________________________________
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是
A.蔗糖、麦芽糖水解都能得到2种物质
B.纤维素、淀粉和蛋白质都是高分子化合物
C.石油分馏可获得乙烯、丙烯和丁二烯
D.酯类和糖类均能发生水解反应
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法或有关化学用语的表达正确的是( )
A.在基态多电子原子中,p轨道电子能量一定高于s轨道电子能量
B.基态Fe原子的外围电子排布图为: ![]()
C.因氧元素电负性比氮元素大,故氧原子第一电离能比氮原子第一电离能大
D.根据原子核外电子排布的特点,Cu在周期表中属于s区元素
查看答案和解析>>
科目: 来源: 题型:
【题目】短周期元素A、B、C、D,其有关性质或结构信息如表所示.
元素 | A | B | C | D |
有关性质或结构信息 | 能形成+7价的化合物 | 基态原子核外s能级上的电子数是p能级上的电子数的2倍 | 该元素形成的单质通常有两种同素异形体,其中一种单质分布在高空,起着阻止紫外辐射的作用 | 通常情况下能形成短周期中最稳定的双原分子分子 |
(1)B位于元素周期表中第周期第族,元素B和元素C相比,电负性较小的是(写元素名称).化合物BC2晶体与B的单质晶体属(填同一类型或不同类型).
(2)写出元素C的含有10个中子的一种核素符号 , B的一种氢化物B2H2分子中σ键与π键的数目之比为 .
(3)C与D可以组成多种形式的化合物.其中D2C5能勾水反应生成物质X.写出物质X的稀溶液与过景的Fe反应的离子方程式:
(4)A的最髙价氧化物为无色液体,9.15g该物质与足跫的水混合,得到一种稀溶液,并放出QKJ热量,该反应的热化学反应方程式为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com