
科目: 来源: 题型:
【题目】化学中常借助曲线图来表示某种变化过程,有关下列四个曲线图的说法正确的是

A. 曲线图①可以表示对某化学平衡体系改变温度后反应速率随时间的变化
B. 曲线图②可以表示向一定量的氢氧化钠溶液中滴加一定浓度的稀硫酸时pH变化
C. 曲线图③可以表示相同pH的CH3COOH和HCl溶液分别加水稀释时溶液的pH随溶液体积变化的曲线
D. 曲线图④可以表示所有的固体物质溶解度随温度的变化
查看答案和解析>>
科目: 来源: 题型:
【题目】在一定温度下,将气体X和气体Y各0.16mol充入10L恒容密闭容器中,发生反应X(g)+Y(g)![]() 2Z(g) ΔH<0,一段时间后达到平衡,反应过程中测定的数据如下表:
2Z(g) ΔH<0,一段时间后达到平衡,反应过程中测定的数据如下表:
t/min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
下列说法正确的是
A. 该温度下此反应的平衡常数K=1.44
B. 其他条件不变,降低温度,反应达到新平衡前ν(逆)>ν(正)
C. 反应前2min的平均速率ν(Z)=2.0×10-3mol·L-1·min-1
D. 其他条件不变,再充入0.2mol Z,平衡时X的体积分数增大
查看答案和解析>>
科目: 来源: 题型:
【题目】汽车尾气中的污染物有固体悬浮颗粒、一氧化碳、碳氢化合物、氮氧化合物铅及硫氧化合物等。下列说法中正确的是
A. 固体悬浮颗粒是造成雾霾天气的一种重要因索
B. 一氧化碳、氮氧化合物是酸雨形成的主要因素
C. 硫氧化合物不仅能形成酸雨,还能形成光化学烟雾
D. 汽车尾气可通过净化装置将碳氢化合物还原成CO2和H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】根据所给信息填空
(1)用0.1mol/L的酸性高锰酸钾溶液测定FeSO4溶液的浓度时,因FeSO4溶液放置时间较长,导致测定结果(填“偏大”、“不变”或“偏小”)
(2)过氧化钠的电子式
(3)选出下列说法中正确的
①氧化物都能与酸或碱的溶液反应
②红宝石、玛瑙、水晶、钻石等装饰品的主要成分都是硅酸盐
③由相同元素组成的物质一定是纯净物
④浓氨水滴加到FeCl3溶液中可制取Fe(OH)3胶体
⑤向容量瓶中转移液体时,玻璃棒不可以接触到容量瓶的瓶口
⑥用铂丝蘸取少量某溶液进行焰色反应,火焰呈黄色,该溶液一定是钠盐溶液
⑦金属Mg的活泼性比Al强,由Al2O3能与NaOH溶液反应推知MgO也能与NaOH溶液反应
⑧SiO2既能和NaOH溶液反应也能和氢氟酸反应,所以是两性氧化物
⑨3mol单质Fe在氧气中完全转变为Fe3O4 , 失去8NA个电子
⑩用含硅胶、铁粉的透气小袋与食品一起密封包装,利用了Fe粉的还原性
(4)浓硝酸久置变黄
(5)明矾溶液与少量氢氧化钡溶液反应的离子方程式 .
查看答案和解析>>
科目: 来源: 题型:
【题目】现有常温下pH=2的盐酸甲和pH=2的醋酸溶液乙,请根据下列操作回答问题:
(1)常温下0.lmol/L的CH3COOH溶液加水稀释过程,下列表达式的数据一定增大的是__________
A.c(H+) B.c(H+)/c(CH3COOH) C.c(H+)·c(OH-) D.c(OH-)/c(H+)
(2)取10mL乙溶液,加入等体积水,醋酸的电离平衡___________(填“向左”、“向右”或“不”)移动;另取10mL的乙溶液,加入少量无水醋酸钠固体 (假设加入固体前后,溶液体积保持不变),待固体溶解后,溶液中c(H+)/c(CH3COOH)的比值将___________(填“增大”“ 减小”或“无法确定”)。
(3)取等体积的甲、乙两溶液,分别用等浓度的NaOH稀溶液中和,则消耗的NaOH溶液的体积大小关系为:V(甲)___________V(乙) (填“>”、“ <”或“=”)。
(4)已知25℃时,两种酸的电离平衡常数如下:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数K1 | 1.8×l1-5 | 4.3×l0-7 | 3.0×10-8 |
K2 | - - | 5.6×10-11 | - - |
下列四种离子结合H+能力最强的是___________;
A.HCO3- B.CO32- C.ClO- D.CH3COO-
(5)常温下,取甲溶液稀释100倍,其pH=___________;取99mL甲溶液与lrnLlmol/L的NaOH溶液混合(忽略溶液体积变化),恢复至常温时其pH=______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关煤、石油,天然气等资源的说法正确的是
A. 石油分馏属于化学变化 B. 天然气是一种清洁的化石燃料
C. 煤就是碳,属于单质 D. 水煤气是通过煤的液化得到的气体燃料
查看答案和解析>>
科目: 来源: 题型:
【题目】氮、磷及其化合物在生产、生活中有重要的用途。回答下列问题:
(1)在碱性条件下,次磷酸盐可用于化学镀银,完成其反应的离子方程式:______。
H2PO2-+Ag+ =PO43-+Ag+ 。
由工业白磷(含少量砷、铁、镁等)制备髙纯白磷(熔点44℃,沸点280℃),主要生产流程如下:

(2)关于除砷条件的说法合理的是_______(填字母)。
a. 75℃使白磷熔化,并溶于水 b.硝酸浓度不易过大,防止白磷反应
c.温度不宜过高,防止硝酸分解 d.适当提高温度,加快化学反应速率
(3)硝酸氧化除砷时被还原为NO,氧化相同质量的砷,当转化为亚砷酸的量越多,消耗硝酸的量越____(填“多”或“少”)。
(4)某条件下,用一定量的硝酸处理一定量的工业白磷,砷的脱除率及磷的产率随硝酸质量分数的变化如图,砷的脱除率从a点到b点降低的原因是__________________。
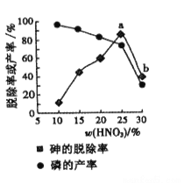
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com