
科目: 来源: 题型:
【题目】按要求回答下列问题: 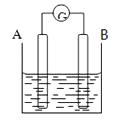
(1)若电流表的指针偏向B,则A为极,B为极
(2)若电流表G发生偏转,同时A极质量增加,B极质量减少,C为电解质溶液.则A、B、C分别为
A.A是Zn,B是Cu,C是稀硫酸
B.A是Cu,B是Zn,C是稀硫酸
C.A是Fe,B是Ag,C是稀AgNO3溶液
D.A是Ag,B是Fe,C是稀AgNO3溶液
(3)若电解质溶液是稀硫酸,按此图组装后,观察到A极不断的溶解,B极有气泡冒出,则A,B的金属性强弱为
(4)任何一个自发的氧化还原反应都可以设计为原电池,若该电池中发生的反应为:Fe+2FeCl3═3FeCl2 , A电极为铁,则B电极为 .
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、C、D是四种短周期元素,A元素所在的周期数、主族序数和原子序数均相等;B原子的最外层电子数是次外层电子数的3倍;C是第三周期原子半径最大的元素;D的单质工业上用于制漂白粉,也用于自来水的消毒.用元素符号或化学式回答下列问题:
(1)C元素在周期表中的位置 , D的单质与水反应的离子方程式为 .
(2)C的离子结构示意图为 , A、B、C形成的化合物的电子式为 .
(3)B、C形成的化合物可用作供氧剂,写出供氧时发生的化学方程式: .
查看答案和解析>>
科目: 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的是
A.溴水中有下列平衡Br2+H2O![]() HBr+HBrO,当加入硝酸银溶液后,溶液颜色变浅
HBr+HBrO,当加入硝酸银溶液后,溶液颜色变浅
B.加催化剂,使N2和H2在一定条件下转化为NH3
C.反应CO(g)+NO2(g)CO2(g)+NO(g) ΔH<0,达平衡后,升高温度体系颜色变深
D.增大压强,有利于SO2与O2反应生成SO3
查看答案和解析>>
科目: 来源: 题型:
【题目】三种正盐的混合溶液中含有0.2molNa+,0.25molMg2+,0.4molCl﹣,则溶液中SO42﹣的物质的量为
A. 0.1 mol B. 0.3 mol C. 0.5 mol D. 0.15 mol
查看答案和解析>>
科目: 来源: 题型:
【题目】NaClO2是一种重要的杀菌消毒剂,也常用来漂白织物等,其一种生产工艺如图,回答下列问题: 
(1)ClO2的沸点为283K,纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下更安全.写出“反应”步骤中生成ClO2的化学方程式 .
(2)“尾气吸收”是吸收“电解”过程排出的少量ClO2 .
①在尾气吸收过程中,可代替H2O2的试剂是(填序号).
A.Na2O2B.Na2S C.FeCl2D.KMnO4
②提高尾气的吸收效率的可行措施有(填序号).
A.尾气吸收时充分搅拌吸收液B.适当加快尾气的通入速率C.将温度控制在20℃以下D.加水稀释尾气吸收液
③此吸收反应中,氧化剂与还原剂的物质的量之比为 .
(3)在碱性溶液中NaClO2比较稳定,在酸性溶液中,ClO2﹣和H+合为HClO2 , HClO2
是唯一的亚卤酸,不稳定,易分解产生Cl2、ClO2和H2O,写出HClO2分解的化学方程式: .
(4)已知NaClO2的溶解度随温度升高而增大,NaClO2饱和溶液在38℃以上60℃以下会析出NaClO2 , 在NaClO2析出过程中可能混有的杂质是(填化学式).
查看答案和解析>>
科目: 来源: 题型:
【题目】下列反应既是氧化还原反应,又是放热反应的是( )
A.铝与稀盐酸的反应
B.Ba(OH)28H2O与NH4Cl的反应
C.灼热的碳与二氧化碳的反应
D.NaOH与HCl的反应
查看答案和解析>>
科目: 来源: 题型:
【题目】将50g密度ρ=0.98g/mL的10%的氨水和100g密度ρ=0.93g/mL的40%的氨水混合,得到ρ=0.95g/mL氨水溶液,求所得氨水的物质的量浓度是多少?
查看答案和解析>>
科目: 来源: 题型:
【题目】某溶液可能含有Cl﹣、SO42﹣、CO32﹣、NH4+、Fe3+、Al3+和K+ . 取该溶液100mL,加入过量NaOH溶液,加热,得到0.02mol气体,同时产生红褐色沉淀;过滤,洗涤,灼烧,得到1.6g固体;向上述滤液中加足量BaCl2溶液,得到4.66g不溶于盐酸的沉淀.由此可知原溶液中( )
A.至少存在5种离子
B.Cl﹣一定存在,且c(Cl)≥0.4mol/L
C.SO42﹣、NH4+、一定存在,Cl﹣可能不存在
D.CO32﹣、Al3+一定不存在,K+可能存在
查看答案和解析>>
科目: 来源: 题型:
【题目】一定温度下,10ml 0.40mol/L H2O2溶液发生催化分解。不同时刻测得生成O2的体积(已折算为标准状况)如下表。
t/min | 0 | 2 | 4 | 6 | 8 | 10 |
V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
下列叙述不正确的是(溶液体积变化忽略不计)( )
A. 0~6min的平均反应速率: v(H2O2)≈3.3×10-2mol/(L·min)
B. 6~10min的平均反应速率: v(H2O2)<3.3×10-2mol/(L·min)
C. 反应至6min时, c(H2O2)=0.30mol·L-1
D. 反应至6min时,H2O2分解了50%
查看答案和解析>>
科目: 来源: 题型:
【题目】一定温度下,在三个容积均为2.0L的恒容密闭容器中发生反应:2NO(g)+2CO(g)N2(g)+2CO2(g)
各容器中起始物质的量与反应温度如下表所示,反应过程中甲、丙容器中CO2的物质的量随时间变化关系如下图所示:
容器 | 温度/℃ | 起始物质的量/mol | |
NO (g) | CO (g) | ||
甲 | T1 | 0.20 | 0.20 |
乙 | T1 | 0.30 | 0.30 |
丙 | T2 | 0.20 | 0.20 |
下列说法正确的是( )
A.该反应的正反应为吸热反应
B.达到平衡时,乙中CO2的体积分数比甲中的小
C.T1℃时,若起始时向甲中充入0.40 mol NO、0.40mol CO、0.40mol N2和0.40mol CO2 , 则反应达到新平衡前v(正)<v(逆)
D.T2℃时,若起始时向丙中充入0.06mol N2和0.12 mol CO2 , 则达平衡时N2的转化率大于40%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com