
科目: 来源: 题型:
【题目】科学家近年来研制出一种新型细菌燃料电池,利用细菌将有机酸转化为氢气,氢气进入以磷酸为电解质的燃料电池发电。电池的负极反应为( )
A. H2-2e-+2OH-=2H2O B. O2+4e-+4H+=2H2O
C. H2-2e-=2H+ D. O2+4e-+2H2O=4OH-
查看答案和解析>>
科目: 来源: 题型:
【题目】下列离子方程式正确的是( )
A.工业上用石灰乳制备漂白粉:Ca(OH)2+Cl2=Ca2++ClO﹣+Cl﹣+H2O
B.向硫酸铝铵溶液中滴加少量Ba(OH)2溶液:NH4++Al3++2SO42﹣+2Ba2++5OH﹣=AlO2﹣+2BaSO4↓+NH3H2O+2H2O
C.制备Fe(OH)3胶体:Fe3++3H2OFe(OH)3(胶体)+3H+
D.用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO4﹣+6H++5H2O2=2Mn2++5O2↑+8H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】图是将SO2转化为重要的化工原料H2SO4的原理示意图,下列说法不正确的是( ) 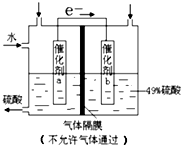
A.该装置将化学能转化为电能,电流方向为b→a
B.催化剂b表面O2发生还原反应,其附近酸性增强
C.催化剂a表面的反应:SO2+2H2O﹣2e﹣=SO ![]() +4H+
+4H+
D.若得到的硫酸浓度仍为49%,则理论上参加反应的SO2与加入的H2O的质量比为8:15
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是( )
A. PH=1的醋酸加水稀释到原体积的100倍,稀释后PH=3
B. 室温 pH=3的醋酸溶液和pH=11的Ba(OH)2溶液等体积混合后溶液呈酸性
C. 室温pH相同的NH4Cl溶液和CH3COOH溶液,由水电离产生的c(H+)相同
D. 某温度下,水的离子积常数为1×10-12,该温度下PH=7的溶液呈中性
查看答案和解析>>
科目: 来源: 题型:
【题目】按要求书写方程式:
(1)H2CO3的电离方程式______________________________________________________;
(2)AgCl的沉淀溶解平衡方程式_______________________________________________;
(3)NaHCO3 溶液与 AlCl3溶液混合的离子方程式_______________________________;
(4)向CaSO4悬浊液中加入固体Na2CO3 ,写出对应的离子方程式_______________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】炼锌厂产生的工业废渣——锌渣(除了含Zn 外,还含有Fe、Al、Cd (镉)和SiO2等杂质),利用锌渣制取并回收ZnSO4·7H2O 和金属镉(Cd)是一个有益的尝试,流程如下:
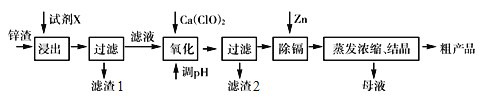
已知:金属活动性Zn> Cd
物质 | Fe(OH)3 | Al(OH)3 | Zn(OH)2 | Cd(OH)2 | Fe(OH)2 |
完全沉淀时的PH | ≥3.2 | ≥4.7 | ≥6.5 | ≥9.4 | ≥9.7 |
试回答下列问题:
(1)第一步浸出时用到的试剂X为__________,滤渣1的成分是___________。
(2)加入Ca(ClO)2 的目的是氧化Fe2+,写出反应的离子方程式____________________。
(3)调节pH 过程可以选用;本流程的pH 调节一般调至5,其目的是_____________________。
(4)写出过滤后加入过量的锌粉反应的离子方程式__________________。
(5)在蒸发浓缩操作时,要保持一定的酸度,其目的是______。
查看答案和解析>>
科目: 来源: 题型:
【题目】HArF是第一个被发现的氩化合物,其分子的比例模型如图所示,在HArF中氟为﹣1价,氩为0价,其水溶液显强酸性,酸性与盐酸相当.下列有关说法错误的是( ) 
A.稀有气体在一定条件下也可发生化学反应
B.HAlF为极性分子
C.ArF﹣具有较强的氧化性
D.向HArF溶液中加入NaOH,反应的离子方程式为:H++OH﹣═H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】A,B分别为第三、四两周期同一主族的不同元素的原子,它们原子核内的质子数等于中子数.①若A为ⅡA族,其质量数为X,则B的质子数为Y;②若A为ⅣA族,其质子数为m,则B质量数为n,则Y和n的值是( )
A.( ![]() +18)和(2m+18)
+18)和(2m+18)
B.( ![]() +8)和(2m+18)
+8)和(2m+18)
C.( ![]() +8)和(2m+36)
+8)和(2m+36)
D.( ![]() +18)和(2m+36)
+18)和(2m+36)
查看答案和解析>>
科目: 来源: 题型:
【题目】铝是一种重要金属,从铝土矿(主要成分为Al2O3 , Fe2O3、SiO2等)中冶炼Al的工业生产流程如下图:
(1)溶液A中含的阳离子主要有 .
(2)写出步骤II生成溶液C 的离子方程式 , 步骤I、II、III都要用到的分离方法是 .
(3)生产过程中,除CaO可以循环使用外,还可以循环使用的物质有(填化学式).
(4)生产中曾用铝与氧化铁的混合物形成铝热剂发生铝热反应焊接钢轨(提示:反应中能生成铁单质),则铝与氧化铁在高温下发生反应的化学方程式为:
(5)经分析,a吨铝土矿可以冶炼出b吨的铝(假设各生产环节中无损耗),则原铝土矿中Al2O3的纯度(质量分数)(用含a、b的最简式表示).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com