
科目: 来源: 题型:
【题目】关于下列材料说法不正确是( )
序号 | 材料 | 类别 | 性能 | 用途 |
A | 钛合金 | 金属材料 | 密度小,强度高 | 制飞机机翼 |
B | 普通玻璃 | 硅酸盐材料 | 熔点高,透明 | 制试管、烧杯 |
C | 压电陶瓷 | 半导体材料 | 具有压电效应 | 声纳、地震仪 |
D | 氮化硅陶瓷 | 新型无机非金属材料 | 硬度高,耐磨 | 制发动机 |
A. AB. BC. CD. D
查看答案和解析>>
科目: 来源: 题型:
【题目】有关物质的转化关系如下图所示(部分生成物和反应条件已略去)。D、F、G、H均为常见气体,其中D能使湿润的红色石蕊试纸变蓝;G呈绿色,H在空气中含量最高;C的摩尔质量为32g/mol;E为难溶性碱。
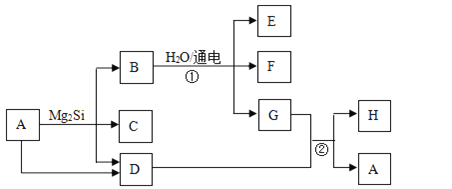
(1)C的化学式为_________。
(2)H的电子式为_________。
(3)写出反应①的离子方程式: _________。
(4)写出反应②的化学方程式: _________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法中错误的是( )
A.通常蔗糖和淀粉都不显还原性
B.用大米酿的酒在一定条件下密封保存,时间越长越香醇
C.纤维素、蔗糖、葡萄糖和脂肪在一定条件下都可发生水解反应
D.纤维素分子是由葡萄糖单元组成的,可以表现出一些多元醇的性质
查看答案和解析>>
科目: 来源: 题型:
【题目】金刚烷是一种重要的化工原料,工业上可通过下列途径制备: 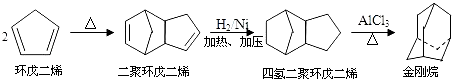
请回答下列问题:
(1)环戊二烯分子中最多有个原子共平面;
(2)金刚烷的分子式为 , 其分子中的CH2基团有个;其二氯取代物有种.
(3)下面是以环戊烷为原料制备环戊二烯的合成路线: 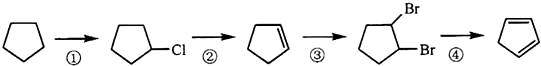 其中,反应③的反应类型是 .
其中,反应③的反应类型是 .
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学兴趣小组按照下列流程进行“由镁铝合金制备硫酸铝晶体”的实验如图1.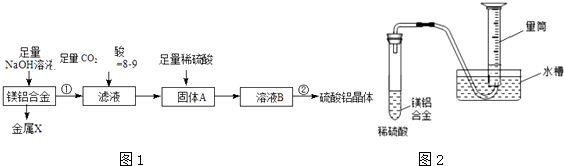
(1)写出硫酸铝在水中的电离方程式 ,
(2)镁铝合金中加NaOH溶液的离子反应方程式为 , 滤液中通入足量CO2的化学方程式
(3)操作②包含的步骤有蒸发浓缩、、过滤、干燥.
(4)金属X在CO2中燃烧的化学方程式
(5)该兴趣小组为测定镁铝合金中各组成的质量分数,设计如图2装置,则需要测定的数据(温度、压强除外)有、 .
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上用CO生产燃料甲醇.一定条件下发生反应:CO(g)+2H2(g)CH3OH(g). 
(1)图1是表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化情况.从反应开始到平衡,用CO浓度变化表示平均反应速率v(CO)=
(2)图2表示该反应进行过程中能量的变化.曲线a表示不使用催化剂时反应的能量变化,曲线b表示使用催化剂后的能量变化.该反应是(选填“吸热”或“放热”)反应,写出反应的热化学方程式 .
(3)该反应平衡常数K为 , 温度升高,平衡常数K(填“增大”、“不变”或“减小”).
(4)恒容条件下,下列措施中能使 ![]() 增大的有 .
增大的有 .
a.升高温度 b.充入He气
c.再充入2molH2 d.使用催化剂.
查看答案和解析>>
科目: 来源: 题型:
【题目】如图是某同学设计的制备少量氯气并进行系列实验的装置(夹持及加热仪器已略).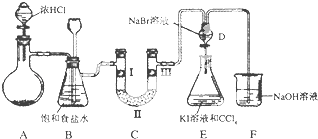
(1)若装置A中制备氯气选用的药品为固体二氧化锰和浓盐酸,请写出装置A中化学反应的离子方程式:;
(2)实验室也可用高锰酸钾制氯气:2KMnO4+16HCl(浓)═5Cl2↑+2MnCl2+2KCl+8H2O①请用双线桥标出该反应的电子转移方向和数目.
②该反应中的氧化剂是 , 若消耗0.2mol氧化剂,则被氧化的还原剂的物质的量是 .
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中I、Ⅱ、Ⅲ依次放入;(提示:硅胶是干燥剂,不与氯气反应)
a | b | c | d | |
Ⅰ | 干燥的有色布条 | 干燥的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
Ⅱ | 碱石灰 | 硅胶 | 碱石灰 | 无水氯化钙 |
Ⅲ | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
(4)设计装置D、E的目的是比较氯、溴、碘单质的氧化性强弱.当向D中缓缓通入少量氯气时,D中发生反应的离子方程式为 , 若打开D装置的活塞,使D中溶液滴入E装置,振荡锥形瓶后静置一会儿,可以观察到的现象是 .
查看答案和解析>>
科目: 来源: 题型:
【题目】T℃时,在容积为0.5 L的密闭容器中发生某一反应,且测得不同时间容器中四种物质A、B、C、D的物质的量变化如下图所示.已知:物质A、B、C均为气态,D为固态,正反应是吸热反应。
根据要求回答下列问题:
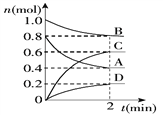
(1)容器中反应的化学方程式为_________________________________.
(2)前2 min,v(A)=___________mol/(L·min)
(3)能说明该反应已达到平衡状态的是_________(填字母,下同).
A.混合气体的压强不变 B.混合气体的密度不变
C.消耗0.1 mol B同时生成0.1 mol D D.B的物质的量不变
(4)反应达到平衡后,改变下列措施能使A的转化率增大的是________.
A.只增加A的物质的量 B.移走一部分D
C.升高反应体系的温度 D.把容器的体积缩小一倍
(5)合成甲醇的主要反应为:CO(g)+2H2(g)![]() CH3OH(g) △H<0,其化学平衡常数K和温度T的关系如下表所示:
CH3OH(g) △H<0,其化学平衡常数K和温度T的关系如下表所示:
T/℃ | T1 | T2 | T3 |
K | 1/1000 | 1/40 | 25 |
T1、T2、T3的大小关系为__________________________
查看答案和解析>>
科目: 来源: 题型:
【题目】在证明海带中存在碘元素的实验操作中,主要仪器选用错误的是( )
选项 | 操作 | 主要仪器 |
A | 称取3.0g干海带 | 托盘天平 |
B | 灼烧干海带至完全变成灰烬 | 蒸发皿 |
C | 过滤煮沸后的海带灰与水的混合液 | 漏斗 |
D | 用四氯化碳从氧化后的海带灰浸取液中提取碘 | 分液漏斗 |
A.AB.BC.CD.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com