
科目: 来源: 题型:
【题目】一定温度下,下列溶液的离子浓度关系式正确的是( )
A. pH=5的H2S溶液中,c(H+)=c(HS-)=1×10-5mol·L-1
B. pH=a的氨水溶液,稀释10倍后,其pH=b,则a=b+1
C. pH=2的乙二酸(H2C2O4)溶液与pH=12的NaOH溶液任意比例混合:c(Na+)+c(H+)=c(OH-)+c(HC2O4-)
D. pH相同的①CH3COONa②NaHCO3③NaClO三种溶液的c(Na+):①>②>③
查看答案和解析>>
科目: 来源: 题型:
【题目】HA和HB两种酸的溶液分别加水稀释时,pH变化的简图如图所示,下列叙述中不正确的是( )

A. HA是一种强酸
B. x点,c(A-)=c(B-)
C. HB是一种弱酸
D. 原溶液中HA的物质的量浓度为HB的10倍
查看答案和解析>>
科目: 来源: 题型:
【题目】在碱性溶液中能大量共存,且溶液为无色透明的是
A. K+、Na+、MnO4-、SO42- B. NH4+、Mg2+、NO3-、SO42-
C. Na+、K+、Cl-、CO32- D. Fe3+、Cu2+、Cl-、SO42-
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于有机化合物的叙述错误的是
A.甲烷和乙烯可以用溴水鉴别
B.煤油是石油的分馏产品,可用于保存少量的钠
C.棉花、蛋白质和油脂都是高分子化合物,水解产物均为电解质
D.用饱和碳酸钠溶液可除去乙酸乙酯中混有的乙酸和乙醇
查看答案和解析>>
科目: 来源: 题型:
【题目】在 2L 容积不变的密闭容器内,800℃时反应 2NO(g)+O2(g)═2NO2(g)体系中,n(NO)随时间的变化如下表:
t/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)用O2的反应速率表示 0~2s 内该反应的平均反应速率 v= . 若上述反应在850℃下进行,反应2s时 n(NO)=0.009mol,并且不再随时间而改变,则该反应是热反应.
(2)图中表示NO2浓度变化的曲线是(填字母). 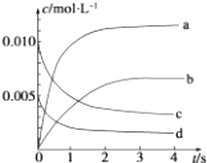
(3)能说明该反应已达到平衡状态的是(填序号).
A.v(NO2)=2v(O2)
B.容器内的压强保持不变
C.v逆(NO)=2v正(O2)
D.容器内气体密度保持不变
(4)能使该反应的反应速率增大,且平衡向正反应方向移动的是(填序号).
A.及时分离出NO2
B.适当升高温度
C.增大O2的浓度
D.选择高效催化剂.
查看答案和解析>>
科目: 来源: 题型:
【题目】氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,
(1)如图是N2(g)和H2(g)反应生成1mol NH3(g)过程中能量变化示意图,请写出N2和H2反应的热化学方程式:; 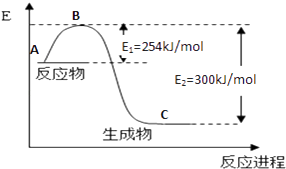
(2)若已知下列数据:
化学键 | H﹣H | N≡N |
键能/kJmol﹣1 | 435 | 943 |
试根据表中及图中数据计算N﹣H的键能kJmol﹣1
(3)合成氨反应通常用铁触媒作催化剂.使用铁触媒后E1和E2的变化是:E1 , E2(填“增大”、“减小、”“不变”).
(4)用NH3催化还原NOX还可以消除氮氧化物的污染.例如 4NH3(g)+3O2(g)=2N2(g)+6H2O(g);△H1=akJ/mol
N2(g)+O2(g)=2NO(g);△H2=bkJ/mol
若1mol NH3还原NO至N2 , 则该反应过程中的反应热△H3=kJ/mol(用含a、b的式子表示)
查看答案和解析>>
科目: 来源: 题型:
【题目】25℃时,Ksp(BaSO4)=1×10-10,Ksp(BaCO3)=2.6×10-9。该温度下,下列说法不正确的是( )
A. 同浓度的Na2SO4和Na2CO3混合溶液中滴加BaCl2溶液,BaSO4先析出
B. BaCO3的悬浊液中加入少量的新制氯水,c(Ba2+)增大
C. BaSO4和BaCO3共存的悬浊液中, 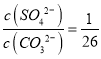
D. BaSO4悬浊液中加入Na2CO3浓溶液,BaSO4不可能转化为BaCO3
查看答案和解析>>
科目: 来源: 题型:
【题目】如图表示各物质之间的转化关系.已知D、E、Z是中学化学常见的单质,其他都是化合物.Z、Y是氯碱工业的产品.D元素的原子最外层电子数与电子层数相等,且D的硫酸盐可作净水剂.E为日常生活中应用最广泛的金属.除反应①外,其他反应均在水溶液中进行.请回答下列问题.
(1)写出X的电子式: .
(2)常温时pH=12的G溶液中,溶质的阳离子与溶质的阴离子浓度之差为(写出计算式).
(3)在电镀工业中,若将E作为待镀金属,铜为镀层金属,则铜是极,请写出在E电极上发生的电极反应式: .
(4)写出反应③的离子方程式: .
(5)现有无标签的Y和M的两种无色水溶液,不用其他任何试剂,请你设计一个简单的实验对这两种溶液加以鉴别(回答实验操作、现象及结论).
(6)A溶液与NaOH溶液混合可形成沉淀,某温度下此沉淀的Ksp=2.097×l0﹣39 . 将0.01mol/L的A溶液与0.001molL﹣1的NaOH溶液等体积混合,你认为能否形成沉淀(填“能”或“不能”),请通过计算说明 .
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法中正确的是( )
A.0.1molL﹣1的NaCl溶液中,Na+与Cl﹣离子总数为0.2NA
B.标准状况下,2.24L水的质量是1.8g
C.16gO3比16gO2所含的氧原子数多
D.22gCO2与标准状况下11.2L Cl2含有相同的分子数
查看答案和解析>>
科目: 来源: 题型:
【题目】高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压.高铁电池的总反应为:3Zn+2K2FeO4+8H﹣1O ![]() 3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是( )
3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是( )
A.放电时每转移3mol电子,正极有1mol K2FeO4被氧化
B.充电时阳极反应为:Fe(OH)3﹣3e﹣+5 OH﹣═FeO ![]() +4H2O
+4H2O
C.放电时正极附近溶液的碱性增强
D.放电时负极反应为:Zn﹣2e﹣+2OH﹣═Zn(OH)2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com