
科目: 来源: 题型:
【题目】前四周期原子序数依次增大的六种元素A、B、D、X、Y、Z,基态时核外电子排布具有以下特征:A的电子层数和最外层电子数相等,非金属元素B的已成对电子数是未成对电子数的2倍,且A和B位于不同周期;D和X的价电子层中未成对电子均只有1个,并且D﹣和X+的电子相差为8;Y、Z与X位于同一周期,它们价电子层中的未成对电子数分别为4和2,且原子序数相差为2.回答下列问题:
(1)Z2+的价层电子排布式为 .
(2)D、X、Y三种元素中第一电离能从大到小的顺序是 . (填元素符号)
(3)分子式为AD的化合物常以多聚体(AD)n的形式存在,请解释原因 .
(4)B和氮原子可形成化合物(BN)2 , (BN)2分子中中心原子的杂化方式为 , φ键和π键的个数之比为 , 空间构型为 .
(5)D﹣、X+、Y3+三种离子组成的化合物X3YD6 , 其中化学键的类型有;该化合物中存在一个复杂离子,该离子的化学式为 , 配位体是 .
(6)Y晶体的晶胞如图所示,晶胞边长为apm,则Y的配位数为 , 晶体的密度为g/cm3 . (用NA 表示阿伏伽德罗常数的值)
查看答案和解析>>
科目: 来源: 题型:
【题目】用内置有螺旋状铜丝的胶头滴管小心吸取一滴管浓硝酸后迅速插入细口瓶中(如右图),滴管与瓶口接触处垫一小块滤纸使滴管与瓶口留少量空隙,依次观察到如下现象:①滴管内产生红棕色气体,液面下降;②滴管内液面上升,气体变成无色;③滴管内液面再次下降.下列说法中错误的是( ) 
A.现象①中产生的红棕色气体为NO2
B.产生现象②的原因是NO2与水反应
C.产生现象③的原因是铜与稀硝酸反应
D.最终瓶内溶液中的溶质只有Cu(NO3)2
查看答案和解析>>
科目: 来源: 题型:
【题目】下列解释事实的化学方程式或离子方程式不正确的是( )
A.工业上可角电解法制备Mg:MgCl2(熔融) ![]() Mg+C12↑
Mg+C12↑
B.用FeSO4除去酸性废水中的Cr2O72﹣:Cr2O72﹣+Fe2++14H+═2Cr3++Fe3++7H2O
C.用CaSO4治理盐碱地:CaSO4(s)+Na2CO3(aq)?CaCO3(s)+Na2SO4(aq)
D.向Ca(ClO)2溶液中通入少量CO2:Ca2++2ClO﹣+H2O+CO2═2HClO+CaCO3↓
查看答案和解析>>
科目: 来源: 题型:
【题目】硫代硫酸钠溶液与稀硫酸反应的化学方程式为: Na2S2O3+ H2SO4=Na2SO4+SO2+S↓+H2O,下列各组实验中最先出现浑浊的是
实验 | 反应温度/℃ | Na2S2O3溶液 | 稀H2SO4 | H2O | ||
V/mL | c/(mol·L-1) | V/mL | c/(mol·) | V/mL | ||
A | 25 | 5 | 0.1 | 10 | 0.1 | 5 |
B | 25 | 5 | 0.2 | 5 | 0.2 | 10 |
C | 35 | 5 | 0.1 | 10 | 0.1 | 5 |
D | 35 | 5 | 0.2 | 5 | 0.2 | 10 |
查看答案和解析>>
科目: 来源: 题型:
【题目】海水是巨大的资源宝库,海水的综合利用具有重要意义(如下图)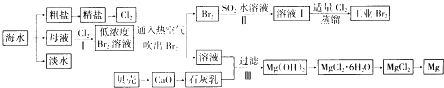
(1)氯碱工业主要以食盐为原料,为了除去粗盐中的Ca2+、Mg2+、SO42﹣及泥沙,可将粗盐溶于水,然后进行下列操作:①加过量的NaOH溶液;②加过量的BaCl2溶液③加过量的Na2CO3溶液;④过滤;⑤加适量的盐酸,第③步操作的目的是
(2)在实验室可以用萃取的方法提取溴,在萃取操作过程中,下列说法不正确的是 .
A.萃取剂可选用苯、CCl4、裂化汽油等有机溶剂.
B.萃取分液时下层液体从下口放出,上层液体从上口倒出
C.在萃取过程中,需要振荡分液漏斗,并打开分液漏斗上口的玻璃塞放气.
(3)通入热空气吹出溴,并用SO2的水溶液吸收的目的是 .
(4)步骤Ⅰ中用硫酸酸化可提高Cl2利用率的原因是 .
(5)步骤Ⅲ中有关反应的离子方程式 , 解释该反应能够发生的原因 .
(6)海水提溴蒸馏过程中,温度应控制在80﹣90℃,温度过高或过低都不利于生产,请解释原因 .
(7)工业上不用电解熔融MgO制金属镁,理由是 .
查看答案和解析>>
科目: 来源: 题型:
【题目】运用有关概念判断下列叙述正确的是( )
A.能够完全电离的电解质称为强电解质,如硫酸、盐酸、氢氧化钠等是强电解质
B.1mol甲烷燃烧放出的热量为甲烷的燃烧热
C.中和反应都有盐和水生成,有盐和水生成的反应都属于中和反应
D.风能是正在探索的新能源之一,它是太阳能的一种转换形式,具有不稳定
查看答案和解析>>
科目: 来源: 题型:
【题目】有甲、乙两个完全相同的装置,分别在它们的侧管中装入1.06g Na2CO3和0.84g NaHCO3 , 试管中各有10mL相同浓度的盐酸(如图),同时将两个侧管中的物质全部倒入各自的试管中,下列叙述正确的是( ) 
A.甲装置的气球膨胀速率大
B.若最终两气球体积相同,则一定有c(HCl)≥2 mol/L
C.若最终两气球体积不同,则一定有c(HCl)≤1 mol/L
D.最终两溶液中Na+、Cl﹣的物质的量相同
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上SnSO4是一种重要的硫酸盐,广泛应用于镀锡工业,其制备路线如下:
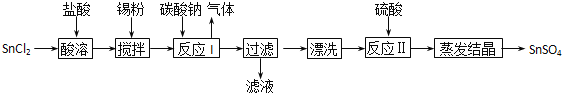
提示:①已知在酸性条件下,锡在水溶液中有Sn2+、Sn4+两种主要存在形式.
②已知Ksp[Sn(OH)2] =1.0×10-26
(1)SnCl2用盐酸而不用水直接溶解的原因是______,加入Sn粉的作用是_______。
(2)反应I生成的沉淀为SnO,写出该反应的离子方程式_____________________。
(3)反应Ⅱ硫酸的作用之一是控制溶液的pH,若溶液中c(Sn2+)=1.0molL-1,则应控制溶液pH的范围是________。
(4)实验室拟用以下装置,用熔融的金属锡与干燥纯净的氯气制取无水SnCl4(SnCl4熔点-33℃,沸点114.1℃,遇潮湿空气极易水解),此反应过程放出大量的热。
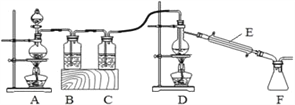
①装置C中应加入试剂为__________;仪器E的名称为__________________。
②反应开始生成SnCl4时,可以熄灭_______(填字母序号)处的酒精灯,理由是______。
③该实验装置设计尚存在缺陷,改进的方法是(包括缺少的仪器、试剂及连接位置等)______________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列叙述正确的是( )
A.硫离子的结构示意图为 
B.核外电子排布相同的微粒化学性质也相同
C.氢弹中用到的2H,3H互为同位素
D.同种元素的原子均有相同的质子数和中子数
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com