
科目: 来源: 题型:
【题目】对某一可逆反应来说,使用催化剂的作用是( )
A.提高反应物的平衡转化率
B.以同样程度改变正逆反应的速率
C.增大正反应速率,减小逆反应速率
D.改变平衡混合物的组成
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室通常用MnO2和浓盐酸共热制取Cl2 , 反应的化学方程式为MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O.
MnCl2+Cl2↑+2H2O.
(1)该反应的氧化剂是 , 氧化产物是 , 用双线桥法表示上述反应电子转移方向和数目.
(2)计算当有73.0克HCl完全参加反时,消耗MnO2的物质的量为多少?生成的气体在标准状况下的体积多少升?
查看答案和解析>>
科目: 来源: 题型:
【题目】氢化钙(CaH2)固体是登山运动员常用的能源提供剂.氢化钙要密封保存,一旦接触到水就发生反应生成氢氧化钙和氢气,氢化钙在一定条件下与氧气反应生成的产物不只一种.氢化钙通常用氢气与金属钙加热制取,如图1是模拟制取装置. 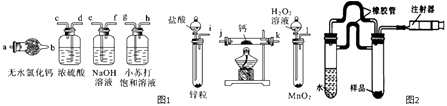
请回答下列问题:
(1)利用上述装置制取氢化钙时按气流方向连接顺序为(填仪器接口的字母编号).
i→→→→→→→a
(2)装有无水氯化钙装置的作用是 .
(3)根据完整的实验装置进行实验,实验步骤如下:检查装置气密性后,装入药品;打开分液漏斗活塞;(请按正确的顺序填入下列步骤的标号).
A.加热反应一段时间
B.收集气体并检验其纯度
C.关闭分液漏斗活塞
D.停止加热,充分冷却
(4)甲同学设计了一个实验,测定上述实验中得到的氢化钙的纯度.请完善下列实验步骤:
①样品称量;
②加入溶液(填化学式),搅拌;
③(填操作名称);洗涤;干燥
④称量碳酸钙.
(5)利用上述题目中给出的装置(试剂可另选)设计实验,用化学方法证明产物中含有氢化钙,写出实验简要步骤及观察到的现象 .
(6)乙同学利用图2所示装置测定上述实验中得到的氢化钙的纯度.他称取46mg所制得的氢化钙样品,记录开始时注射器活栓停留在lO.00mL刻度处,反应结束后充分冷却,活栓最终停留在57.04mL刻度处(上述气体体积均在标准状况下测定).试通过计算求样品中氢化钙的纯度: .
查看答案和解析>>
科目: 来源: 题型:
【题目】(2017·湖南省怀化市普通高中学生学业水平模拟考试)下列行为符合化学实验安全要求的是
A.做实验剩余的金属钠直接丢弃在废液缸中
B.配制稀硫酸时,将水缓慢倒入浓硫酸中并不断搅拌
C.点燃CH4前,检验气体的纯度
D.大量有毒氯气(密度比空气大)氯气泄漏时,迅速离开现场并尽量往低处去
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是
A.摩尔是一种国际基本物理量
B.在同温同压下,相同体积的任何气体单质所含分子数相同
C.标准状况下气体摩尔体积约为22.4 L
D.1 mol氧的质量为16 g
查看答案和解析>>
科目: 来源: 题型:
【题目】在FeCl3溶液蚀刻铜箔制造电路板的工艺中,废液处理和资源回收的过程简述如下:(己知:Ksp[Fe(OH)3]=4.0×10﹣38) Ⅰ:向废液中投入过量铁屑,充分反应后分离出固体和滤液:
Ⅱ:向滤液中加入一定量石灰水,调节溶液pH,同时鼓入足量的空气.
回答下列问题:
(1)FeCl3蚀刻铜箔反应的离子方程式为:
(2)过程Ⅰ加入铁屑的主要作用是 , 分离得到固体的主要成分是 , 从固体中分离出铜需采用的方法是;
(3)过程Ⅱ中发生反应的化学方程式为;
(4)过程Ⅱ中调节溶液的pH为5,金属离子浓度为 . (列式计算)
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示装置中,观察到电流计指针偏转;M棒变粗;N棒变细,由此判断表中所列M、N、P物质,其中可以成立的是( )
M | N | P | |
A | Zn | Cu | 稀H2SO4溶液 |
B | Cu | Fe | 稀HCl溶液 |
C | Ag | Zn | AgNO3溶液 |
D | Zn | Fe | Fe(NO3)3溶液 |

A.A
B.B
C.C
D.D
查看答案和解析>>
科目: 来源: 题型:
【题目】孔雀石的主要成分为Cu2(OH)2CO3 , 还含少量二价铁和三价铁的氧化物及硅的氧化物.如图1是实验室以孔雀石为原料制备胆矾晶体的流程图: 
请回答下列问题:
(1)溶液A中的金属离子有 . 从下列所给试剂中选择:实验步骤中试剂①为(填代号)
a、KMnO4 b、HNO3c、H2O2 d、Cl2
(2)根据图2有关数据,你认为工业上加入试剂①氧化操作时应采取的措施是:溶液温度控制在℃,pH控制在 , 氧化时间为小时左右.
(3)欲测定溶液A中Fe2+的浓度,可用KMnO4标准溶液滴定,反应中MnO4﹣还原为Mn2+ , 取A溶液20.00mL,用去0.0240mol/L KMnO4溶液16.00mL时,恰好达到滴定终点,则A溶液中Fe2+浓度为mol/L.
(4)请设计一种实验方案检验溶液C中Fe3+是否完全除去(写出操作步骤、现象和结论) .
(5)由溶液C获得胆矾晶体,需要经过蒸发浓缩、、过滤等操作.除烧杯漏斗外过滤操作还用到另一玻璃仪器,该仪器在此操作中的主要作用是 .
(6)为测定胆矾中结晶水数目,称取24.8g硫酸铜晶体盛装在干燥的
(填仪器名称)里,灼烧至质量不再改变时,称量粉末的质量为16.0g.,则计算得胆矾(CuSO4nH2O)中n=(计算结果精确到0.1).
查看答案和解析>>
科目: 来源: 题型:
【题目】氯碱厂电解饱和食盐水制取NaOH溶液的工艺流程示意图如图1,完成下列填空: 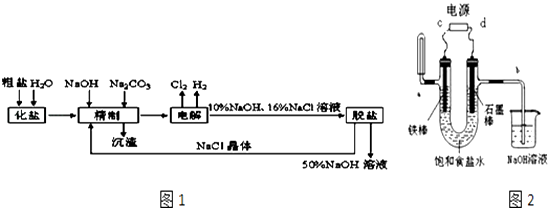
(1)在电解过程中,与电源负极相连的电极上电极反应为 , 与电源正极相连的电极附近,溶液pH(选填“不变”、“升高”或“下降”).
(2)工业食盐含Ca2+、Mg2+等杂质,精制过程发生反应的离子方程式为 , .
(3)如果粗盐中SO42﹣含量较高,必须添加钡试剂除去SO42﹣ , 该钡试剂可以是 .
A.BaCl2
B.Ba(NO3)2
C.BaCO3
(4)用以如图2装置电解饱和食盐水时a处收集到的气体是U型管左边铁棒附近滴入紫色石蕊颜色变化为 , C为电源的极.B处导气管中产生的气体可用检验.
(5)电解足够长时间后发现相同条件下a出和b处产生的气体体积比接近2:1,此时将电源正负极互换则U型管内现象是 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com