
科目: 来源: 题型:
【题目】如图是恒温下某反应的化学反应速率随反应时间变化的示意图.下列叙述与示意图不相符合的是( ) 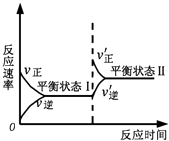
A.反应达平衡时,正反应速率和逆反应速率相等
B.该反应达到平衡状态Ⅰ后,减小反应物浓度,平衡发生移动,达到平衡状态Ⅱ
C.该反应达到平衡状态Ⅰ后,增大反应物浓度,平衡发生移动,达到平衡状态Ⅱ
D.同一种反应物在平衡状态Ⅰ和平衡状态Ⅱ时浓度不相等
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,关于溶液的稀释说法正确的是( )
A.将1 L 0.1molL﹣1的Ba(OH)2溶液加水稀释为2L,pH=13
B.pH=3的醋酸溶液加水稀释100倍,pH=5
C.pH=4的H2SO4加水稀释100倍,溶液中由水电离产生的[H+]=1×10﹣6molL﹣1
D.pH=8的NaOH溶液加水稀释100倍,其pH=6
查看答案和解析>>
科目: 来源: 题型:
【题目】某实验小组同学模拟工业制碘的方法,探究ClO3﹣和I﹣的反应规律.实验操作及现象如表:
实验及试剂 | 编号 | 无色NaClO3 | 试管中 | 淀粉KI |
| 1 | 0.05 mL | 浅黄色 | 无色 |
2 | 0.20 mL | 深黄色 | 无色 | |
3 | 0.25 mL | 浅黄色 | 蓝色 | |
4 | 0.30 mL | 无色 | 蓝色 |
(1)取实验2后的溶液,进行如图实验: 
经检验,上述白色沉淀是AgCl.写出加入0.20mL NaClO3后,溶液中ClO3﹣和I﹣发生反应的离子方程式: .
(2)查阅资料:一定条件下,I﹣和I2都可以被氧化成IO3﹣ .
作出假设:NaClO3溶液用量增加导致溶液褪色的原因是过量的NaClO3溶液与(1)
中的反应产物继续反应,同时生成Cl2 .
进行实验:
①取少量实验4中的无色溶液进行如图实验,进一步佐证其中含有IO3﹣ . 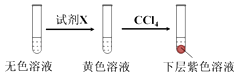
其中试剂X可以是(填字母序号).
a.碘水b.KMnO4溶液c.NaHSO3溶液
②有同学提出,仅通过湿润淀粉KI试纸变蓝的现象不能说明生成Cl2 , 便补充了如下实验:将实验4中的湿润淀粉KI试纸替换为湿润的淀粉试纸,再滴加0.30mL 1.33molL﹣1NaClO3溶液后,发现湿润的淀粉试纸没有明显变化.进行以上对比实验的目的是 , 进一步佐证实验4中生成了Cl2 . 获得结论:NaClO3溶液用量增加导致溶液褪色的原因是(用离子方程式表示).
(3)小组同学继续实验,通过改变实验4中硫酸溶液的用量,获得如表实验结果:
编号 | 6.0 molL﹣1 H2SO4溶液用量 | 试管中溶液颜色 | 淀粉KI试纸颜色 |
5 | 0.25 mL | 浅黄色 | 无色 |
6 | 0.85 mL | 无色 | 蓝色 |
①对比实验4和5,可以获得的结论是 .
②用离子方程式解释实验6的现象: .
查看答案和解析>>
科目: 来源: 题型:
【题目】简单原子的原子结构可用下图的表示方法形象表示,其中●表示质子或电子,○表示中子,则有关①②③的叙述正确的是( ) 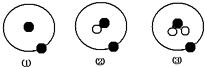
A.①②③是化学性质不同的粒子
B.①不是核素,②③才是核素
C.①②③具有相同的质量数
D.①②③互为同位素
查看答案和解析>>
科目: 来源: 题型:
【题目】为更好地表示溶液的酸碱性,科学家提出了酸度(AG)的概念:AG=1g ![]() ,则下列叙述不正确的是( )
,则下列叙述不正确的是( )
A.中性溶液的AG=0
B.碱性溶液的AG>0
C.AG越小碱性越强,酸性越弱
D.常温下0.1molL﹣1氢氧化钠溶液的AG=﹣12
查看答案和解析>>
科目: 来源: 题型:
【题目】从下列事实所得出的相应结论正确的是( )
实验事实 | 结论 | |
A | Cl2的水溶液可以导电 | Cl2是电解质 |
B | 将燃烧的镁条放入CO2中能继续燃烧 | 还原性:Mg>C |
C | 将Na2CO3溶液与苯酚悬浊液混合溶液变澄清 | 酸性:苯酚>HCO3- |
D | 常温下白磷可自燃而氮气须在放电时才与氧气反应 | 非金属性:P>N |
A.AB.BC.CD.D
查看答案和解析>>
科目: 来源: 题型:
【题目】有A、B、C、D、E、F、G原子序数依次递增的七种元素,它们都是短周期的主族元素.其中:A元素原子的半径最小;B元素的气态氢化物与其最高价含氧酸可生成一种盐;C原子M层电子数是K层的一半;F原子得到两个电子后与Ar原子核外电子排布相同;C、E、F的最高价氧化物的水化物都能两两之间发生反应.请回答下列问题:
(1)F原子的原子结构示意图是 , G元素形成的单质的结构式为 .
(2)用电子式表示A与C形成的化合物的形成过程 .
(3)B,D,E三种原子的原子半径由大到小的顺序为(用元素符号回答) .
(4)共价化合物FG2中所有原子都满足最外层8电子构型,请写出FG2的电子式 .
(5)写出C、E的最高价氧化物的水化物之间反应的离子方程式 .
查看答案和解析>>
科目: 来源: 题型:
【题目】铁炭混合物(铁屑和活性炭的混合物)、纳米铁粉均可用于处理水中污染物.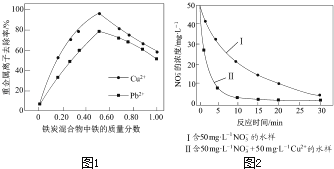
(1)铁炭混合物在水溶液中可形成许多微电池.将含有Cr2O72﹣的酸性废水通过铁炭混合物,在微电池正极上Cr2O72﹣转化为Cr3+ , 其电极反应式为 .
(2)在相同条件下,测量总质量相同、铁的质量分数不同的铁炭混合物对水中Cu2+和Pb2+的去除率,结果如图1所示.
①当铁炭混合物中铁的质量分数为0时,也能去除水中少量的Cu2+和Pb2+ , 其原因是 .
②当铁炭混合物中铁的质量分数大于50%时,随着铁的质量分数的增加,Cu2+和Pb2+的去除率不升反降,其主要原因是 .
(3)纳米铁粉可用于处理地下水中的污染物.
①一定条件下,向FeSO4溶液中滴加碱性NaBH4溶液,溶液中BH4﹣(B元素的化合价为+3)与Fe2+反应生成纳米铁粉、H2和B(OH)4﹣ , 其离子方程式为 .
②纳米铁粉与水中NO3﹣反应的离子方程式为:4Fe+NO3﹣+10H+═4Fe2++NH4++3H2O。
研究发现,若pH偏低将会导致NO3﹣的去除率下降,其原因是 .
③相同条件下,纳米铁粉去除不同水样中NO3﹣的速率有较大差异(见图2),产生该差异的可能原因是 .
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:某原电池的总反应为:2Fe3++Cu═2Fe2++Cu2+ . 则: ①该原电池的正极材料可以选用(填材料名称): , 该电极的电极反应式是: ,
②若负极质量减少1.28克,那么电路中转移的电子数为: .
查看答案和解析>>
科目: 来源: 题型:
【题目】下列事实,不能用平衡移动原理解释的是( )
A.硫酸工业中,增大O2的浓度有利于提高SO2的转化率
B.将FeS固体投入到含有Cu2+的废水中以除去Cu2+
C.选择合适的催化剂可使水在较低温度下分解
D.滴有酚酞的CH3COONa溶液,加热后颜色变深
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com