
科目: 来源: 题型:
【题目】根据题意解答
(1)肼(N2H4)可作为火箭发动机的燃料,与氧化剂N2O4反应生成N2和水蒸气.
已知:①N2(g)+2O2(g)=N2O4 (g)△H1=﹣195kJmol﹣1
②N2H4 (1)+O2(g)=N2(g)+2H2O(g)△H2=﹣534.2kJmol﹣1
写出肼和N2O4 反应的热化学方程式;
(2)肼一空气燃料电池是一种碱性电池,无污染,能量高,有广泛的应用前景.其工作原理如图所示,回答下列问题: 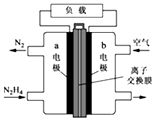
①该燃料电池的负极发生的反应式为 .
②电池工作时,OH﹣移向极(“a”或“b”)
③当电池放电转移5mol电子时,至少消耗燃料肼g.
(3)LiCoO2可用作一种锂离子电池的正极材料.该锂离子电池充电过程中,负极发生的反应为6C+xLi++xe﹣═LixC6 , 正极发生LiCoO2与Li1﹣xCoO2之间的转化,写出放电时电池总反应方程式 .
查看答案和解析>>
科目: 来源: 题型:
【题目】已知正丁烷、异丁烷燃烧的热化学方程式分别为: CH3CH2CH2CH3(g)+ ![]() O2(g)→4CO2(g)+5H2O(l)△H=﹣2878kJmol﹣1
O2(g)→4CO2(g)+5H2O(l)△H=﹣2878kJmol﹣1
(CH3)2CHCH3(g)+ ![]() O2(g)→4CO2(g)+5H2O(l)△H=﹣2869kJmol﹣1
O2(g)→4CO2(g)+5H2O(l)△H=﹣2869kJmol﹣1
则下列说法正确的是( )
A.正丁烷的燃烧热大于异丁烷,故正丁烷分子中的碳氢键比异丁烷的多
B.正丁烷的稳定性大于异丁烷
C.正丁烷转化为异丁烷的过程是一个放热过程
D.正丁烷分子储存的能量小于异丁烷分子
查看答案和解析>>
科目: 来源: 题型:
【题目】非金属单质A经如图所示的过程转化为含氧酸D.已知D为强酸,请回答下列问题:A ![]() B
B ![]() C
C ![]() D,若A在常温下为气体,C是红棕色的气体.
D,若A在常温下为气体,C是红棕色的气体.
(1)、 A,C的化学式分别是:A、C .
(2)、D的浓溶液在常温下可与铜反应并生成C气体,请写出该反应的化学方程式;该反应(填“属于”或“不属于”)氧化还原反应.
查看答案和解析>>
科目: 来源: 题型:
【题目】某烃的结构简式如图,下列说法不正确的是( ) 
A.1mol该烃完全燃烧消耗O211mol
B.与氢气完全加成后的产物中含2个甲基
C.1mol该烃完全加成消耗Br23mol
D.分子中一定共平面的碳原子有6个
查看答案和解析>>
科目: 来源: 题型:
【题目】根据题意进行计算:
(1)向200mL0.5mol/LAl2(SO4)3溶液中,加入350mL2mol/L NaOH溶液,充分反应后可以得到Al(OH)3沉淀多少g?
(2)若想得到3.9g Al(OH)3沉淀,应向200mL0.5mol/LAl2(SO4)3溶液中加入2mol/L NaOH溶液多少mL?
查看答案和解析>>
科目: 来源: 题型:
【题目】根据实验内容填空:
(1)甲同学利用下列装置来进行铜跟浓硫酸反应实验. 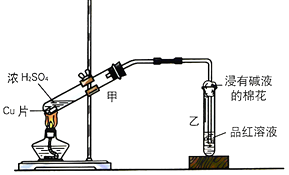
①写出甲装置中发生的主要反应的化学方程式 .
②乙同学认为,若要用铜制取硫酸铜,可以先用铜和氧气反应生成氧化铜,然后利用氧化铜和稀硫酸反应可以得到硫酸铜.若要制取硫酸铜,请你从环境保护和节约资源的角度分析,比较甲同学和乙同学制取硫酸铜的方法中更合理的是 , 原因是 . 
(2)丙同学利用下图的方法实验室制取并验证SO2某些性质,并将实验情况记录在表中,请完成以下表格:
装置序号 | 实验现象或作用 | 实验结论或化学方程式 |
① | 有气泡产生 | 化学方程式为: |
② | 紫色石蕊试液变色 | 证明SO2溶于水显酸性 |
③ | 品红溶液褪色 | 证明SO2具有性 |
④ | 溶液变浑浊 | 证明SO2具有性 |
⑤ | 溴水褪色 | 证明SO2具有性 |
⑥ | 吸收尾气 | 证明SO2属于性氧化物 |
查看答案和解析>>
科目: 来源: 题型:
【题目】根据问题填空:
(1)氨气是中学化学中常见气体之一,实验室制取氨气的化学方程式是 , 氨气的收集方法是 , 实验室用于干燥氨气的干燥剂是 .
(2)下列除杂方法正确的是 . ①碳酸氢钠固体中混有碳酸钠,可以用加热的方法除去.
②镁粉中混有少量铝粉,可以用氢氧化钠溶液溶解,然后过滤.
③食盐中混有硫酸钠、氯化镁和氯化钙几种可溶性杂质,可以分别按顺序加入过量的氢氧化钠溶液、碳酸钠溶液、氯化钡溶液,最后用适量盐酸.
④氯气中混有少量氯化氢气体,可以通入饱和食盐水除去.
⑤氯化亚铁溶液中混有氯化铁溶液,加入铜粉除去.
查看答案和解析>>
科目: 来源: 题型:
【题目】Cl2、ClO2等气体可作为水处理等方面有广泛应用的高效安全消毒剂.我国从2 000年起逐步用ClO2代替氯气对饮用水进行消毒.
(1)工业制漂白粉的化学方程式为 .
(2)消毒水时,ClO2还可将水中的Fe2+、Mn2+等转化成Fe(OH)3和MnO2等难溶物除去,说明ClO2具有性.
(3)工业上在80℃时电解氯化钠溶液得到 NaClO3 , 然后与盐酸反应得到ClO2 . 电解时生成ClO3﹣的电极反应式为 .
(4)自来水厂用ClO2处理后的水中,要求ClO2的浓度在0.1~0.8mg/L之间.碘量法可以检测水中ClO2的浓度,步骤如下:
Ⅰ.取一定体积的水样,加入一定量的碘化钾,再用氢氧化钠溶液调至中性,并加入淀粉溶液,溶液变蓝.
Ⅱ.加入一定量的Na2S2O3溶液.(已知:2S2O32﹣+I2═S4O62﹣+2I﹣)
Ⅲ.加硫酸调节水样pH至1~3.
操作时,不同pH环境中粒子种类如图所示: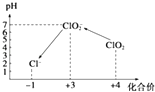
请回答:
①操作Ⅰ中反应的离子方程式是 .
②确定操作Ⅱ完全反应的现象是 .
③在操作Ⅲ过程中,溶液又呈蓝色,反应的离子方程式是 .
④若水样的体积为1.0L,在操作Ⅱ时消耗了1.0×10﹣3 mol/L的Na2S2O3溶液10mL,则水样中ClO2的浓度是mg/L.
查看答案和解析>>
科目: 来源: 题型:
【题目】下列叙述中不正确的是 ( )
A. 摩尔质量的常用单位为g·mol-1
B. 阿伏加德罗常数约为6.02×1023 mol-1
C. 二氧化硫的摩尔质量为64 g·mol-1
D. 摩尔质量就是相对原子质量的6.02×1023倍
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com