
科目: 来源: 题型:
【题目】元素周期表是一座开放的“元素大厦”,“元素大厦”尚未“客满”。请你在“元素大厦”中为由俄罗斯科学家利用回旋加速器成功合成的119号超重元素安排好它的房间( )
A. 第八周期第ⅠA族
B. 第七周期第ⅦA族
C. 第七周期0族
D. 第六周期第ⅡA族
查看答案和解析>>
科目: 来源: 题型:
【题目】短周期主族元素W、X、Y、Z的原子序数依次增加,K、L、M均是由这些元素组成的二元化合物,甲、乙分别是元素X、Y的单质,甲是常见的固体,乙是常见的气体.K是无色气体,是主要的大气污染物之一,0.05mol/L丙溶液的pH为l,上述物质的转化关系如图所示.下列说法正确的是( ) 
A.原子半径:W<X<Y
B.元素的非全属性:Z>Y>X
C.化合物XYZ中只含共价键
D.K、L、M中沸点最高的是M
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是 ( )
A. 硫酸、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物
B. 蔗糖、硫酸钠和水分别属于非电解质、强电解质和弱电解质
C. 点燃的镁条不能在二氧化碳气体中继续燃烧
D. 含0.2molH2SO4的浓硫酸与足量的铜反应,生成标准状况下的气体2.24L
查看答案和解析>>
科目: 来源: 题型:
【题目】已知下列反应的反应热:
①CH3COOH(l)+2O2(g)=2CO2 (g)+2H2O(l)△H=﹣870.3kJ∕mol
②C(S)+O2(g)=CO2 (g)△H=﹣393.5kJ∕mol
③2C(S)+2H2(g)+O2(g)=CH3COOH(l)△H=﹣488.3kJ∕mol
请写出H2燃烧热的热化学方程式 .
查看答案和解析>>
科目: 来源: 题型:
【题目】1L1mol/LH2SO4溶液与2L1mol/LNaOH溶液完全反应,放出114.6kJ的热量,由此推知H2SO4与NaOH发生中和反应的中和热为 , 表示该中和热的热化学方程式为 .
查看答案和解析>>
科目: 来源: 题型:
【题目】最近美国科学家实施了一项“天空绿色计划”,通过电解二氧化碳得到碳材料(部分原理如图所示),并利用得到的碳材料生产锂离子电池.下列说法正确的是( ) 
A.图中能量化方式只有一种
B.阳极的电极反应式为2CO32﹣﹣4e﹣=2CO2↑+O2↑
C.若反应中转移1mole﹣ , 则理论上消耗CO32﹣0.5mol
D.当生成12g碳材料时,可收集到22.4L O2
查看答案和解析>>
科目: 来源: 题型:
【题目】已知下列反应的反应热:
①CH3COOH(l)+2O2(g)=2CO2 (g)+2H2O(l)△H=﹣870.3kJ∕mol
②C(S)+O2(g)=CO2 (g)△H=﹣393.5kJ∕mol
③2C(S)+2H2(g)+O2(g)=CH3COOH(l)△H=﹣488.3kJ∕mol
请写出H2燃烧热的热化学方程式 .
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)在反应式:aFeCl2+bKNO3+cHCl=dFeCl3+eKCl+fX+gH2O中,若b=1,d=3,则X的分子式为____________。
(2)完成以下氧化还原反应的离子反应方程式,并标出电子转移的方向和数目:___________
___CrI3+____Cl2+______——____K2CrO4+____KIO4+___KCl+______
【答案】 NO 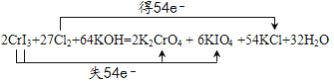
【解析】(1)根据原子守恒得:a=d=3、e=b=1,根据氯原子守恒,则c=4,再由氢原子守恒,则g=2,所以最后根据N、O原子守恒,推出X的化学式为NO,故答案为:NO;
(2)假设CrI3的系数为1,根据Cr元素守恒,K2CrO4的系数为1,根据I守恒,KIO4的系数为3,根据化合价升降守恒,Cl2的系数为![]() ,根据Cl守恒,KCl的系数为27,根据质量守恒定律,反应物中需要一种含有K和O元素的物质,应该为KOH,则生成物中含有H2O,根据K守恒,KOH的系数为32,则H2O的系数为16,因此配平为2CrI3+27Cl2+64KOH =2K2CrO4+6KIO4+54KCl+32H2O,电子转移的方向和数目表示为:
,根据Cl守恒,KCl的系数为27,根据质量守恒定律,反应物中需要一种含有K和O元素的物质,应该为KOH,则生成物中含有H2O,根据K守恒,KOH的系数为32,则H2O的系数为16,因此配平为2CrI3+27Cl2+64KOH =2K2CrO4+6KIO4+54KCl+32H2O,电子转移的方向和数目表示为: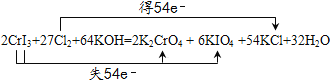 ,故答案为:
,故答案为: 。
。
【题型】填空题
【结束】
26
【题目】A、B、C、W均为中学常见的纯净物,它们之间有如下转化关系(其它产物及反应条件已略去,反应可以在水溶液中进行)。
![]()
(1)若A、B、C三种物质的溶液均显碱性,焰色反应均为黄色,C受热分解转化为B
①A与过量W转化为C的总反应的离子方程式_______________。
②B溶液中通入W生成C的离子方程式_______________。
③A溶液与C溶液反应的化学方程式为_______________。
(2)若B的溶液显黄色,一定条件下B的饱和溶液可与沸水反应生成红褐色分散系
①C溶液中加入氢氧化钠溶液的现象_______________。
②B与W转化为C的离子反应方程式_______________。
③一定条件下W与水反应的化学方程式_______________。
(3)若A为NaOH,且C为白色沉淀
①C为_______________。
②A与某金属单质也可生成B,该反应的离子方程式_______________。
③C溶于A的离子反应方程式_______________。
④B与W混合生成白色沉淀的离子反应方程式_______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】为验证甲烷分子中含有碳、氢两种元素,可将其燃烧产物通过①浓H2SO4;②澄清石灰水;③无水硫酸铜.正确的顺序是( )
A.①②③
B.②③
C.②③①
D.③②
查看答案和解析>>
科目: 来源: 题型:
【题目】氧化铜是一种黑色固体,可溶于稀硫酸。某同学想知道稀硫酸中的哪种粒子(H2O、H+、SO42-)能使氧化铜溶解。请你和他一起通过下图所示Ⅰ、Ⅱ和Ⅲ三个实验完成这次探究活动。
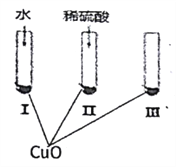
(1)通过实验I可以证明___________________。
(2)要证明另外两种粒子能否溶解氧化铜,还需要进行实验Ⅱ和Ⅲ,在Ⅱ中加入稀硫酸后氧化铜溶解,则进一步确认的实验操作是:在Ⅲ中先加入__________,再加入_________。
(3)探究结果为__________ 。
(4)反应的离子方程式为__________。
【答案】 水不能使氧化铜溶解 可溶性硫酸盐 稀硫酸 H+能溶解氧化铜,而H2O、SO42-两种离子都不能使CuO溶解 CuO+2H+=Cu2++H2O
【解析】(1)实验Ⅰ的试管中的液体成分为水,该实验证明水不溶解CuO;
(2)要想证明起作用的是H+,首先要排除SO42-的干扰,所以在Ⅲ中应该加入可溶性硫酸盐,如Na2SO4(或K2SO4等),最后再加放稀硫酸;
(3)通过对比实验验证起作用的成分,得出结论是:氧化铜固体溶于稀H2SO4是稀硫酸H+在起作用,而H2O、SO42-两种粒子都不能使CuO溶解;
(4)CuO与硫酸电离的氢离子反应生成铜离子和水,反应的离子方程式为:CuO+2H+=Cu2++H2O。
点睛:性质实验方案设计的一般思路、程序是: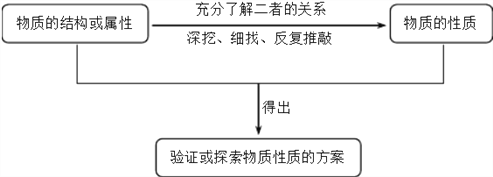 。
。
【题型】实验题
【结束】
28
【题目】(1)己知: 将Cl2通入适量KOH 溶液,产物中可能有KC1、KClO、KC1O3,且c(Cl-):c(C1O-)的值与温度高低有关。当n(KOH)=amol时,若某温度下,反应后c(Cl-):c(C1O-)=11,则溶液中c(ClO-):c(ClO3-)=__________。
(2)在P+CuSO4+H2O→CuP+H3PO4+H2SO4(未配平)的反应中,7.5molCuSO4 可氧化P的物质的量为_______mol。生成1molCu3P时,参加反应的P 的物质的量为_______mol。
(3)一定量的CuS和Cu2S 的混合物投入足量的HNO3中,收集到气体VL(标准状况),向反应后的溶液中(存在Cu2+和SO42-) 加入足量NaOH,产生蓝色沉淀,过滤,洗涤,灼烧,得到CuO16.0g,若上述气体为NO和NO2的混合物,且体积比为1:1,则V的极小值为______L。
(4)向一定量的Fe、FeO、Fe3O4的混合物中,加入1mol/L 硝酸的溶液100mL,恰好使混合物全部溶解,且放出336mLNO (标准状况下),向所得溶液中加入KSCN 溶液,溶液无红色出现; 若取相同质量的Fe、FeO、Fe3O4的混合物,加入1mol/L 的稀硫酸溶液,也恰好使混合物完全溶解(假设还原产物唯一),反应后向所得溶液中加入KSCN溶液,溶液也无红色出现,则所加入的的稀硫酸的体积是______mL。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com