
科目: 来源: 题型:
【题目】用NA表示阿伏加德罗常数,下列叙述正确的是
A.标准状况下,22.4 L空气含有NA个单质分子
B.常温常压下,0.1 mol Na2CO3含有的Na+数目为0.2NA
C.标准状况下,22.4 L H2O含有的分子数为 NA
D.物质的量浓度为0.5 mol·L1的MgCl2溶液中,含有Cl个数为NA
查看答案和解析>>
科目: 来源: 题型:
【题目】在一个体积为1 L的密闭容器中发生某化学反应:2A(g)![]() B(g)+C(g),三种不同条件下进行,其中实验Ⅰ、Ⅱ都在800° C,实验Ⅲ在950°C。B、C的起始浓度都为0,反应物A的浓度(mol L-1)随时间(min)的变化如图所示。试回答下列问题:
B(g)+C(g),三种不同条件下进行,其中实验Ⅰ、Ⅱ都在800° C,实验Ⅲ在950°C。B、C的起始浓度都为0,反应物A的浓度(mol L-1)随时间(min)的变化如图所示。试回答下列问题:

(1)在实验Ⅰ中,反应在2040 min内A的平均反应速率为________mol L-1min-1。实验Ⅱ和实验Ⅰ相比,可能隐含的反应条件是____________。
(2)该反应的ΔH___________0,其判断理由是_____________。
(3)实验Ⅰ第40 min末,若降低反应温度,达到新的平衡后,A的浓度不可能为________(填序号)。
A.0.35 mol·L1 B.0.4 mol·L1 C.0.7 mol·L1 D.0.8 mol·L1
(4)若反应在800°C进行,在该1 L的密闭容器中加入1 mol A、0.2 mol He,达到平衡时A的转化率应____________。
A.等于86% B.等于50% C.小于50% D.在50%86%
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA 为阿伏加德罗常数的值.下列说法正确的是( )
A.标准状况下,2.24 Cl2完全反应生成FeCl3或CuCl2 , 转移的电子数都为0.2NA
B.18g D2O中含有的电子数为10 NA
C.pH=12的氨水中含有NH4+的数目为0.01 NA
D.28g 由乙烯和CO组成的混合物中含有的原子总数为3NA
查看答案和解析>>
科目: 来源: 题型:
【题目】针对网络上流传的隔夜熟肉中因亚硝酸钠(NaNO2)含量严重超标而不能食用的说法,某兴趣小组开展如下探究活动:
活动一:查阅资料
NaNO2有毒,具有较强氧化性和较弱还原性,NaNO2溶液显碱性,国家规定肉制品中NaNO2含量不能超过30mg/kg.
(1)NaNO2溶液显碱性的原因是(用离子方程式表达)
活动二:鉴别NaNO2与食盐
(2)可用稀硫酸、淀粉和KI溶液鉴别,溶液变蓝的是(填化学式)
活动三:探究NaNO3与NaNO2的相互转化
(3)制取NaNO2与NaNO3混合溶液的装置示意图如图. 
已知:2NO2+2NaOH═NaNO2+NaNO3+H2 O
①装置II中的试剂不能为水,理由是 .
②装置III中反应完全后,接下来的操作是打开活塞(选填“a”或“b”,下同),关闭活塞
(4)将NaNO2与NaNO3混合溶液露置于空气,隔夜后,测得溶液的pH减小,则溶液中NaNO2的含量(选填“增多”、“减少”、或“不变”),原因可能是(用化学方程式解释).
活动四:检测熟肉中NaNO2含量的变化
(5)分别从 1000g刚煮熟的肉和 1000g隔夜熟肉中提取NaNO2 , 配成溶液,再分别用0.00500mol/L酸性高锰酸钾溶液滴定,刚煮熟的肉消耗12.00mL,隔夜熟肉消耗16.00mL.(提示:MnO4一转化为Mn2+ , NO2一转化为NO3一)
①在该滴定实验中需要用到的实验仪器有
A.容量瓶 B.酸式滴定管 C.碱式滴定管
D.分液漏斗 E.锥形瓶 F. 烧瓶
②滴定终点的判断依据为 .
③隔夜熟肉中NaNO2的含量是mg/kg,该数据说明保存得当的隔夜熟肉(选填“能”或“不能”)食用.
查看答案和解析>>
科目: 来源: 题型:
【题目】某仅由碳、氢、氧三种元素组成的有机化合物,经测定其相对分子质量为90.取有机物样品1.8g,在纯氧中完全燃烧,将产物先后通过浓硫酸和碱石灰,两者分别增重1.08g和2.64g.
(1)求该有机物的分子式.
(2)若该有机物呈现酸性,且该有机物的核磁共振氢谱图中出现4个吸收峰,面积比为3:1:1:1,写出其结构简式.
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关氢氧化铁胶体说法正确的是
A. 将外加直流电源通过该胶体,阴极处颜色变深,则说明该胶体带正电荷
B. 鉴别FeCl3溶液和Fe(OH)3胶体,可用丁达尔效应或观察颜色两种方法
C. 采用过滤,可将Fe(OH)3胶体中的FeCl3杂质除去
D. 向Fe(OH)3胶体中加入大量盐酸,则可引起胶体聚沉
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示,甲、乙、丙分别表示在不同条件下,可逆反应A(g)+B(g)![]() xC(g)的生成物C的百分含量w(C)和反应时间(t)的关系。
xC(g)的生成物C的百分含量w(C)和反应时间(t)的关系。


(1)若甲中两条曲线分别代表有催化剂和无催化剂的情况,则 曲线代表无催化剂时的情况。
(2)若乙表示反应达到平衡状态后,分别在恒温恒压条件下和恒温恒容条件下向平衡混合气体中充入He后的情况,则 曲线表示恒温恒容的情况,且此时混合气体中w(C) (填“变大”“变小”或“不变”)。
(3)根据丙可以判断该可逆反应的正反应是 (填“放热”或“吸热”)反应,x的值为 。
(4)丁表示在某固定容积的密闭容器中,上述可逆反应达到平衡后,某物理量随温度(T)的变化情况,根据你的理解,丁的纵坐标可以是 (填序号)。
①w(C) ②A的转化率 ③B的转化率 ④压强 ⑤c(A) ⑥c(B)
升高温度,平衡向 (填“正反应”或“逆反应”)方向移动。
查看答案和解析>>
科目: 来源: 题型:
【题目】目前市场上有一种专门为婴幼儿设计的电解质饮料,适合在婴幼儿感冒、发烧时快速补充体内流失的电解质成分。下列物质可用作该饮料中的电解质的是
A.Fe B.葡萄糖 C.MgSO4 D.CO2
查看答案和解析>>
科目: 来源: 题型:
【题目】在密闭容器里,通入x mol H2(g)和y mol I2(g),发生反应:H2(g)+I2(g)![]() 2HI(g) △H<0。达到平衡后,改变下列条件,反应速率将如何改变 (填“增大”“减小”或“不变”)?平衡将如何移动(填“向左”“向右”或“不变”)?
2HI(g) △H<0。达到平衡后,改变下列条件,反应速率将如何改变 (填“增大”“减小”或“不变”)?平衡将如何移动(填“向左”“向右”或“不变”)?
(1)升高温度,反应速率将_________,平衡将如何移动 ;
(2)加入正催化剂,反应速率将_________,平衡将如何移动 ;
(3)充入更多的H2,反应速率将_________,平衡将如何移动 ;
(4)扩大容器的体积,反应速率将_________,平衡将如何移动 ;
(5)容器体积不变,通入氖气,反应速率将___________,平衡将如何移动 ;
查看答案和解析>>
科目: 来源: 题型:
【题目】在一个体积为2 L的密闭容器中,高温下发生反应:Fe(s)+CO2(g)![]() FeO(s)+CO(g)。其中CO2、CO的物质的量(mol)随时间(min)的变化关系如图所示。
FeO(s)+CO(g)。其中CO2、CO的物质的量(mol)随时间(min)的变化关系如图所示。
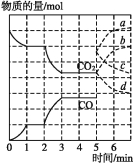
(1)反应在1 min时第一次达到平衡状态,固体的质量增加了3.2 g。用CO2的浓度变化表示的反应速率v(CO2)= 。
(2)反应进行至2 min时,若只改变温度,曲线发生的变化如图所示,3 min时再次达到平衡,则ΔH 0(填“>”“<”或“=”)。
(3)5 min时再充入一定量的CO(g),平衡发生移动。下列说法正确的是 (填写编号)。
A.v(正)先增大后减小 B.v(正)先减小后增大
C.v(逆)先增大后减小 D.v(逆)先减小后增大
表示n(CO2)变化的曲线是 (填写图中曲线的字母编号)。
(4)请用固态物质的有关物理量来说明该反应已经达到化学平衡状态: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com