
科目: 来源: 题型:
【题目】常温下,将NH4NO3溶于水得无色溶液,为使该溶液中的c(NH ![]() ):c(NO
):c(NO ![]() )=1:1,可以采取的下列措施是( )
)=1:1,可以采取的下列措施是( )
A.加入适量的HNO3 , 抑制NH ![]() 水解
水解
B.加入适量的氨水,使溶液的pH等于7
C.再加入适量的NH4NO3(s)
D.加入适量的NaOH,使溶液的pH等于7
查看答案和解析>>
科目: 来源: 题型:
【题目】填空题
(1)已知A、B、C、D是中学化学中常见的四种不同粒子,它们之间存在如图所示的转化关系(反应条件已经略去): 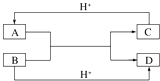
①如果A、B、C、D均是10电子的粒子,请写出:A电子式:;D的结构式: .
②如果A和C是18电子的粒子,B和D是10电子的粒子,请写出:A与B在溶液中反应的离子方程式为 . 根据上述离子方程式,可以判断C与B结合质子的能力大小是 . (用化学式或离子符号表示).
(2)另一10电子物质,相同条件下对H2的相对密度为8,常温常压下,3.2g该物质与足量氧气充分燃烧后放出akJ热量,(a>0).写出该物质燃烧热的热化学方程式: .
将3.2g该物质燃烧后的产物通入100mL3molL﹣1的NaOH溶液中,充分反应后所得的溶液中离子浓度大小关系为: .
查看答案和解析>>
科目: 来源: 题型:
【题目】一个完整的氧化还原反应方程式可以拆开,写成两个“半反应式”,一个是“氧化反应式”,一个是“还原反应式”。如Fe+Cu2+=Fe2++Cu,可拆写为氧化反应式:Fe-2e-=Fe2+,还原反应式:Cu2++2e-=Cu。据此,回答下列问题:
(1)将反应Zn+2H+=Zn2++H2↑拆写为两个“半反应式”:
氧化反应式:_______________________,还原反应式:_______________________。
(2)将反应2Fe3++Cu=2Fe2++Cu2+拆写为两个“半反应式”:
氧化反应式:_______________________,还原反应式:_______________________。
(3)已知某反应的两个“半反应式”为:氧化反应式CH4+10OH--8e-=![]() +7H2O,还原反应式O2+2H2O+4e-=4OH-,则氧化还原反应方程式为___________________。
+7H2O,还原反应式O2+2H2O+4e-=4OH-,则氧化还原反应方程式为___________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】现将600mL稀硫酸等体积分为6份,并向其中5份中分别加入质量不等的Zn粒,并收集生成的氢气,有以下记录结果。(氢气的体积已折算为标准状况)
实验① | 实验② | 实验③ | 实验④ | 实验⑤ | |
Zn质量(g) | 5.0 | 8.0 | 12 | 14 | 16 |
H2体积(L) | 1.72 | 4.14 | 4.48 | 4.48 |
(1)由实验结果可推知,此稀硫酸的物质的量浓度为____________。
(2)实验②收集到H2的体积为____________。
(3)若向第6份稀硫酸中不断加入Zn粒,请在下图中画出H2体积(V)与Zn粒质量(m)的关系图像____________。

查看答案和解析>>
科目: 来源: 题型:
【题目】将2.0mol/L CuSO4溶液和1.0mol/L H2SO4溶液等体积混合(假设混合后溶液的体积等于混合前两种溶液的体积之和)。
(1)混合液中![]() 的物质的量浓度为__________。
的物质的量浓度为__________。
(2)向溶液中加入足量的铁粉,经足够长的时间后,铁粉有剩余,则反应后溶液中Fe2+的物质的量浓度为__________。(假定反应前后溶液的体积不变)
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是( )
A.常温下,PH=9的碳酸钠溶液中由水电离出的c(OH﹣)=1×10﹣9molL﹣1
B.饱和氯水中:c(Cl﹣)=c(ClO﹣)+c(HClO)
C.将pH=4的醋酸溶液稀释后,溶液中所有离子的浓度均降低
D.中和等体积pH相同的H2SO4和HCl溶液,消耗NaOH的物质的量为2:1
查看答案和解析>>
科目: 来源: 题型:
【题目】反应A(g)+B(g)C(g)+D(g)发生过程中的能量变化如图,△H 表示反应的焓变.下列说法正确的是( ) 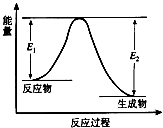
A.反应体系中加入催化剂,反应速率增大,E1减小,E2增大
B.反应体系中加入催化剂,反应速率增大,△H不变
C.△H<0,反应达到平衡时,升高温度,A的转化率增大
D.△H>0,反应达到平衡时,升高温度,A的转化率减少
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com