
科目: 来源: 题型:
【题目】W、X、Y、Z是原子序数依次增大的同一短周期元素,W是金属元素,X是地壳中含量最多的金属元素,且W、X的最高价氧化物的水化物相互反应生成盐和水;Y、Z是非金属元素,Y与W可形成离子化合物W2Y;G在Y的前一周期,其原子最外层比Y原子最外层少一个电子.
(1)X的原子结构示意图为;
(2)W、X的最高价氧化物的水化物相互反应的离子方程式为;
(3)工业上制取X单质的化学方程式为;
(4)G的气态氢化物与Y的最高价氧化物的水化物恰好反应生成的正盐溶液中,离子浓度由大到小的顺序为;在催化剂作用下,汽车尾气中G的氧化物GO与CO两种气体能相互反应转化为无污染、能参与大气循环的两种气体,若有33.6L(已换算成标准状况)一氧化碳参加反应,转移的电子数为mol;
(5)298K时,Z的最高价氧化物为无色液体,0.25mol该物质与一定量水混合得到Z的最高价氧化物的水化物的稀溶液,并放出a kJ的热量,该反应的热化学方程式为 .
查看答案和解析>>
科目: 来源: 题型:
【题目】除杂质:所选试剂都填化学式
(1)除去混入NaCl溶液中少量NaHCO3杂质的试剂是 , 离子方程式为 .
(2)除去FeCl2溶液中混入的FeCl3溶液杂质用试剂是 , 离子方程式为 .
(3)除去Mg粉中混有的少量Al杂质的试剂是 , 离子方程式为 .
(4)除去NaHCO3溶液中混有的少量Na2CO3杂质的试剂是 , 离子方程式为 .
查看答案和解析>>
科目: 来源: 题型:
【题目】请填写以下空白:
(1)有以下物质: ①NaHSO4晶体 ②SO3 ③液态硫酸 ④铁 ⑤BaSO4固体 ⑥饱和 FeCl3溶液 ⑦
酒精(C2H5OH) ⑧熔融的 K2SO4,其中能导电的是__________,属于电解质的是_________,属于非电解质的是______________
(2) 化学反应 FeS+ H2SO4(浓)![]() Fe2(SO4)3+ SO2↑+ S↓+ H2O(未配平)中:
Fe2(SO4)3+ SO2↑+ S↓+ H2O(未配平)中:
氧化产物是:_______, 还原产物是:_______。
(3) 请写出醋酸与氢氧化钠溶液反应的离子方程式_______。
(4) 盐酸可以除铁锈, 请写出发生反应的离子方程式_______。
(5) 工业上常用 H2O2在酸性条件下氧化污水中的 Fe2+,请写出离子方程式:_______。
(6)某液态化合物 X2Y4常用作火箭燃料。 32 g X2Y4在一定量的 O2中恰好完全燃烧,反应方程式为: X2Y4(l)+O2(g) ![]() X2(g)+2Y2O(l)。冷却后在标准状况下测得生成物的体积为 22.4 L,其密度为 1.25 g·L-1。 X2的摩尔质量为_____________, X2Y4化学式为________________。(注: l—液态, g—气态)
X2(g)+2Y2O(l)。冷却后在标准状况下测得生成物的体积为 22.4 L,其密度为 1.25 g·L-1。 X2的摩尔质量为_____________, X2Y4化学式为________________。(注: l—液态, g—气态)
查看答案和解析>>
科目: 来源: 题型:
【题目】检验SO2气体中是否混有CO2的方法是( )
A.先通过足量澄清石灰水,再通过足量品红溶液
B.先通过足量饱和NaHCO3溶液,再通过澄清石灰水
C.先通过足量NaOH溶液,再通过澄清石灰水
D.先通过足量酸性KMnO4溶液,再通过澄清石灰水
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是( )
A.向50mL 1mol?L﹣1的盐酸中加入烧碱,水的KW不变
B.NH4Cl和NH3?H2O混合液中,二者对对方的平衡都起了抑制作用
C.有两种弱酸HX和HY且酸性HX>HY,则体积和浓度相同的NaX和NaY溶液中有c(Y﹣)>c(X﹣)>c(OH﹣)>c(H+)
D.常温下0.1 mol?L﹣1的HA溶液中 ![]() =1×10﹣8 , 则0.01 mol?L﹣1 HA溶液中c(H+)=1×10﹣4mol?L﹣1
=1×10﹣8 , 则0.01 mol?L﹣1 HA溶液中c(H+)=1×10﹣4mol?L﹣1
查看答案和解析>>
科目: 来源: 题型:
【题目】关于晶体的说法正确的是( )
A.若晶体熔融状态下能导电,该晶体一定是离子晶体
B.若晶体熔化时化学键断裂,该晶体一定是原子晶体
C.若晶体中含有非极性分子,该晶体可能有较低的熔沸点
D.若晶体中含有极性共价键,该晶体不可能有很高的熔沸点
查看答案和解析>>
科目: 来源: 题型:
【题目】往1.0molL﹣1KI溶液中加入固体I2 , 发生反应:I2(aq)+I﹣ (aq)═I3﹣(aq)△H;I﹣的物质的量浓度c(I﹣)随温度T的变化曲线如图所示.已知反应第一次达到平衡时用时10s,则下列说法正确的是( ) 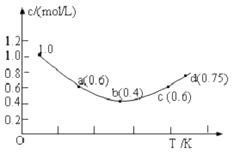
A.该反应的△H>0
B.a、c两点对应的I﹣反应速率相等
C.b点时0~10s I﹣的平均反应速率为0.04molL﹣1s﹣1
D.d点时该反应在对应温度下处于平衡状态
查看答案和解析>>
科目: 来源: 题型:
【题目】Zn还原SiCl4的反应如下:下列说法正确的是( )
SiCl4(g)+2Zn(l)Si(s)+2ZnCl2(g)△H1
SiCl4(g)+2Zn(g)Si(s)+2ZnCl2(g)△H2 .
A.Zn(l)=Zn(g)△H= ![]() (△H1﹣△H2 )
(△H1﹣△H2 )
B.用硅制作的太阳能电池是将化学能转化为电能
C.增加Zn(g)的量,△H2变大
D.以Zn片、铜片和稀硫酸构成的原电池,Zn片表面有气泡产生.
查看答案和解析>>
科目: 来源: 题型:
【题目】一定条件下,向密闭恒容容器中加入1.0mol/L X,发生反应:2X(g)Y(g)+Z(g),△H<0,反应到8min时达到平衡;在14min时改变的温度,16min时建立新平衡.X的物质的量浓度变化如图所示.下列有关说法正确的是( ) 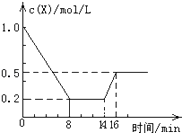
A.0~8min用Y表示的该反应的速度为0.1mol/Lmin
B.8min时达到平衡,该反应的平衡常数为 K=0.5
C.14min时,改变的反应条件是降低了体系的温度
D.16min时的正反应速率,比8min时的正反应速率大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com