
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:阅读理解
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
 2C(g) 已知加入1mol A和2molB,在达到平衡后生成了amolC,此时C在平衡混合物中的体积分数为M%.在相同实验条件下,
2C(g) 已知加入1mol A和2molB,在达到平衡后生成了amolC,此时C在平衡混合物中的体积分数为M%.在相同实验条件下,查看答案和解析>>
科目: 来源: 题型:
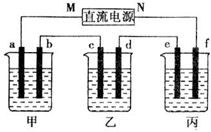 如图甲乙丙三个烧杯依次分别盛放氢氧化钠溶液、硫酸铜溶液、硫酸钾溶液,电极均为石墨电极,通电一段时间,乙中c电极质量增加64克,据此回答问题:
如图甲乙丙三个烧杯依次分别盛放氢氧化钠溶液、硫酸铜溶液、硫酸钾溶液,电极均为石墨电极,通电一段时间,乙中c电极质量增加64克,据此回答问题:查看答案和解析>>
科目: 来源: 题型:
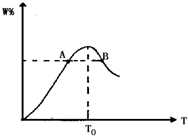 将物质的量均为2.00mol的物质X、Y混合,发生如下反应:2X+Y
将物质的量均为2.00mol的物质X、Y混合,发生如下反应:2X+Y 2W.在反应过程中W的物质的量分数随温度变化如图所示:
2W.在反应过程中W的物质的量分数随温度变化如图所示:查看答案和解析>>
科目: 来源: 题型:
 xC(g)2min时反应平衡,剩余0.8molB,并测得C的浓度为0.4mol/L.回答问题
xC(g)2min时反应平衡,剩余0.8molB,并测得C的浓度为0.4mol/L.回答问题查看答案和解析>>
科目: 来源: 题型:
 cP(g)+dQ(g)达到平衡时.M的体积分数y(M)与反应条件的关系如下图所示.其中:Z表示反应开始时N的物质的量与M的物质的量之比.下列说法正确的是( )
cP(g)+dQ(g)达到平衡时.M的体积分数y(M)与反应条件的关系如下图所示.其中:Z表示反应开始时N的物质的量与M的物质的量之比.下列说法正确的是( )
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com