
科目: 来源: 题型:
【题目】向50 mL 18 mol·L-1的H2SO4溶液中加入适量的铜片并加热。充分反应后,被还原的H2SO4的物质的量( )
A. 小于0.45 mol B. 等于0.45 mol
C. 在0.45~0.90 mol之间 D. 大于0.45 mol
查看答案和解析>>
科目: 来源: 题型:
【题目】在100℃时,将0.200mol的四氧化二氮气体充入2L真空的密闭容器中,每隔一定的时间对该容器内的物质进行分析,得到如表格:
| 0 | 2 | 4 | 6 | 8 | 10 |
c(N2O4) | 0.100 | c1 | 0.050 | c3 | a | b |
c(NO2) | 0.000 | 0.060 | c2 | 0.120 | 0.120 | 0.120 |
试填空:
(1)该反应达到平衡时,四氧化二氮的转化率为%,表中c2c3、ab(填“>”、“<”或“=”).
(2)2min时四氧化二氮的浓度c1=mol/L,在0~2min时间段内,四氧化二氮的平均反应速率为mol/(Lmin).
(3)100℃时,该反应的平衡常数K=
(4)若在相同情况下最初向该容器充入的是二氧化氮气体,要达到上述同样的平衡状态,二氧化氮的起始浓度是mol/L.
查看答案和解析>>
科目: 来源: 题型:
【题目】如图是实验室制备氯气并进行一系列相关实验的装置(夹持及加热仪器已略)。
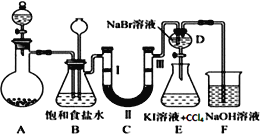
(1)装置 A 中反应的化学反应方程式为:________________________________。装置 B 中饱和食盐水的作用是___________________;同时装置 B 亦是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时 B 中的现象________________________________。
(2)装置 C 的实验目的是验证氯气是否具有漂白性,为此 C 中Ⅰ、Ⅱ、Ⅲ依次放入_____________。(填序号)
a | b | c | d | |
Ⅰ | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
Ⅱ | 碱石灰 | 硅胶 | 浓硫酸 | 无水氯化钙 |
Ⅲ | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
(3)设计装置 D、 E 的目的是验证氯、溴、碘单质的氧化性强弱(Cl2> Br2>I2),当向D中缓缓通入少量氯气时,可以看到无色溶液逐渐变为橙黄色,说明Cl2氧化性>Br2,打开活塞,将装置D中少量溶液加入装置 E中,振荡,观察到的现象是________________________________。
(4)工业上将氯气通入石灰乳制取漂白粉, 化学反应方程式为_____________________________,漂白粉敞放于空气中会失效,请写出失效所发生反应的化学方程式_____________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】铝土矿主要成分Al2O3,还含少量 SiO2、Fe2O3杂质。可用下图制备铝:
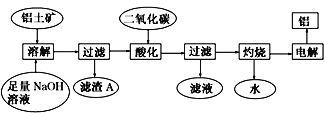
已知 2Na2SiO3+2NaAlO2+2H2O === Na2Al2Si2O8↓+4NaOH。 回答下列问题:
(1)在工艺流程第五步中,灼烧所需的实验仪器除酒精灯、坩埚、坩埚钳、玻璃棒之外,还需要_____________、_________________________。
(2)Na2Al2Si2O8的氧化物形式为_________________________。
(3)滤渣A经多步可制得粗硅 ,请写出由二氧化硅制得粗硅的化学方程式________________。
(4)在工艺流程第三步中,通入过量的二氧化碳时,该反应的离子方程式有_______________, 得到的滤液与足量Ba(OH)2溶液反应的主要离子方程式为 ____________________。
(5)将a g铝土矿经过以上一系列操作之后,最终得到b g Al(不考虑实验过程中操作引起的损耗), 下列说法正确的是____________。 (NA表示阿伏加德罗常数)
A.铝土矿中 Al3+数目小于![]()
B.铝土矿中Al2O3物质的量小于b/54 mol
C.铝土矿中铝元素的质量分数为![]() ×100℅
×100℅
查看答案和解析>>
科目: 来源: 题型:
【题目】己知:Ksp(AgCl)=1.8×10-10 , Ksp(AgI)=1.5×10-16 , Ksp(Ag2CrO4)=2.0×10-12 , 则下列难溶盐的饱和溶液中,Ag+浓度大小顺序正确的是( )
A.AgCl >AgI> Ag2CrO4
B.AgCl> Ag2CrO4 >AgI
C.Ag2CrO4>AgCl >AgI
D.Ag2CrO4>AgI >AgCl
查看答案和解析>>
科目: 来源: 题型:
【题目】把Ca(OH)2固体放入一定量的蒸馏水中,一定温度下达到平衡:Ca(OH)2(s) ![]() Ca2+(aq)+2OH-(aq).当向悬浊液中加少量生石灰后,若温度保持不变,下列判断正确的是 ( )
Ca2+(aq)+2OH-(aq).当向悬浊液中加少量生石灰后,若温度保持不变,下列判断正确的是 ( )
A.溶液中Ca2+数目增多
B.溶液中c(Ca2+)增大
C.溶液pH值不变
D.溶液pH值增大
查看答案和解析>>
科目: 来源: 题型:
【题目】I、为测定金属钠样品(表面有 Na2O)的钠单质的质量分数,设计了如下实验(反应装置如右图所示):
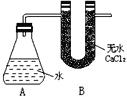
①称量 A、B的总质量 ②称取一定质量的钠样品 ③将钠样品投入锥形瓶中,迅速塞紧带U形干燥管的橡皮塞
有关数据是:称取的金属钠样品质量为a g, A、B反应前总质量为b g,反应后A、B的总质量为c g。
请根据题意回答下列问题:
(1)钠与水反应的离子方程式为________________________________。
(2)用 a、b、c表示的钠单质的质量分数为________________________________。
(3)没有B装置对实验结果有何影响________(填“偏大”或“偏小”“不影响”)?
Ⅱ、现用金属钠和空气制备纯度较高的Na2O2,可利用的装置如下图。回答下列问题(注:Na2O2可以与H2O、CO2反应):
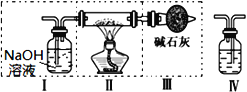
(1)上述装置Ⅳ中盛放的试剂是___________,为完成实验应将装置Ⅳ接在______(选填)。
A.Ⅰ之前 B. Ⅰ和Ⅱ之间 C. Ⅱ和Ⅲ之间 D. Ⅲ之后
(2)装置Ⅲ的作用 ________________________________________________________。
(3)为制得更纯的Na2O2,应______(填“先”或“后”,下同)通空气______点燃酒精灯。
(4)点燃酒精灯后,观察到装置 II 中的现象为 _______________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】利用甲烷与氯气发生取代反应制取副产品盐酸的设想在工业上已成为现实.某化学兴趣小组在实验室中模拟上述过程,其设计的模拟装置如下: 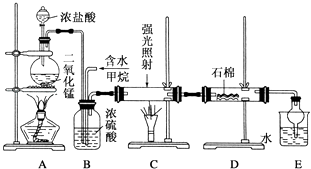
根据设计要求回答:
(1)A装置中发生反应的离子方程式是
(2)B装置有三种功能:①;②均匀混合气体;③干燥混合气体.
(3)在C装置中,经过一段时间的强光照射,发现硬质玻璃管内壁有黑色小颗粒产生,写出置换出黑色小颗粒的化学方程式: .
(4)D装置的石棉中均匀混有KI粉末,其作用是: .
(5)E装置除生成盐酸外,还含有有机物,从E中分离出盐酸的最佳方法为 .
查看答案和解析>>
科目: 来源: 题型:
【题目】某溶液中只含有以下离子中的全部或部分: Ag+、Fe3+、Al3+、H+、SO42-、CO32-、OH-、Cl-,取该溶液做以下实验:
①观察溶液外观, 溶液有颜色;
②取少量该溶液加入Ba(NO3)2溶液, 无现象;
③取该溶液 100 mL,向其中逐滴滴加 1 mol/L的NaOH溶液至过量,生成沉淀物质的量与所加入的 NaOH 溶液的体积关系如图所示。根据实验回答以下问题:
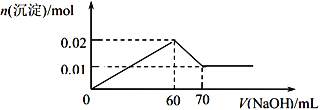
(1)检验溶液中阴离子的离子方程式为________________________________。
(2)根据以上实验推断,溶液中各离子的物质的量浓度分别为________________________________。
(3)若取以上溶液 100 mL,加入足量氨水后过滤,再将所得沉淀洗涤、灼烧,所得固体残留物的物质的量为_____________mol。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列各组离子一定能大量共存的是( )
A. 在无色溶液中:Na+ Fe3+ Cl— SO42-
B. 在含大量Fe3+ 的溶液中:NH4+ K+ NO3- OH-
C. 在强碱溶液中:Na+ K+ NO3- CO32—
D. 滴加紫色石蕊试剂显红的溶液中:K+ Fe2+ Cl— CO32—
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com