
科目: 来源: 题型:
【题目】常温下,已知:Ksp(AgCl)=1.8×10-10,Ksp(Ag2CrO4)=l.1×10-12以及Ksp[Cu(OH)2] =2×10-20。下列说法错误的是
A. 常温下AgCl饱和溶液和Ag2CrO4饱和溶液的物质的量浓度比较:c(AgCl)<c(Ag2CrO4)
B. 常温下,在0.010molL-1的AgNO3溶液中,AgCl与Ag2CrO4分别能达到的最大物质的量浓度比较:c(AgCl)<c(Ag2CrO4)
C. 某CuSO4溶液里c(Cu2+)=0.02 molL-1,如要生成Cu(OH)2沉淀,应调整溶液的pH,使之大于5
D. 要使0.2molL-1 CuSO4溶液中Cu2+沉淀较为完全(使Cu2+浓度降至原来的千分之一),则应向溶液里加入NaOH溶液,使溶液PH为6
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表,下列说法错误的是( )
实验编号 | HA物质的量浓度(molL-1) | NaOH物质的量浓度(molL-1) | 混合溶液的pH |
甲 | 0.2 | 0.2 | a |
乙 | c1 | 0.2 | 7 |
丙 | 0.2 | 0.1 | 7 |
丁 | 0.1 | 0.1 | 9 |
A. 若a=7,HA为强酸;若a>7,HA为弱酸
B. 单从乙组情况分析,c1不一定等于0.2molL-1,混合溶液中离子浓度c(A-)=c(Na+)
C. 从丙组实验结果分析,HA是弱酸,混合溶液中离子浓度c(Na+)=c(A-)>c(OH-)=c(H+)
D. 丁组实验所得混合溶液中由水电离出的c(OH-)=1×10-5 molL-1,c(OH-)-c(HA)= 1×10-10molL-1
查看答案和解析>>
科目: 来源: 题型:
【题目】请回答下列问题.
(1)水的电离平衡曲线如图所示,若A点表示25℃时水的电离达平衡时的离子浓度,B点表示100℃时水的电离达平衡时的离子浓度. 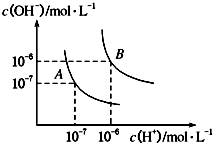
①100℃时1molL﹣1的NaOH溶液中,由水电离出的c(H+)=molL﹣1 , KW(25℃)KW(100℃)(填“>”、“<”或“=”).
②25℃时,向水的电离平衡体系中加入少量NH4Cl固体,对水的电离平衡的影响是(填“促进”、“抑制”或“不影响”).
(2)电离平衡常数是衡量弱电解质电离程度强弱的量.已知如表数据.
化学式 | 电离平衡常数(25℃) |
HCN | K=4.9×10﹣10 |
CH3COOH | K=1.8×10﹣5 |
H2CO3 | K1=4.3×10﹣7、K2=5.6×10﹣11 |
①25℃时,有等浓度的a.NaCN溶液 b.CH3COONa 溶液 c.Na2CO3溶液,三种溶液的pH由大到小的顺序为;(填序号)
②25℃时,等浓度的CH3COOH溶液和NaOH溶液等体积混合,则c(Na+)c(CH3COO﹣)(填“>”、“<”或“=”).
查看答案和解析>>
科目: 来源: 题型:
【题目】草酸是二元中强酸,草酸氢钠溶液显酸性。常温下,向10 mL 0.01 mol/LNaHC2O4溶液中滴加0.01 mol/L NaOH溶液,随着NaOH溶液体积的增加,溶液中离子浓度关系正确的是
A. V(NaOH)=0时,c(H+)=1×10-2mol/L
B. V(NaOH)<10mL时,不可能存在c(Na+)=2c(C2O42-)+c(HC2O4-)
C. V(NaOH)=10mL时,c(H+)=1×10-7mol/L
D. V(NaOH)>10mL时,c(Na+)>c(C2O42-)>c(HC2O4-)
查看答案和解析>>
科目: 来源: 题型:
【题目】一定条件下存在反应C(s)+H2O(g)![]() CO(g)+H2(g) △H>0,向甲、乙、丙三个恒容容器中加入一定量C和H2O,各容器中温度、反应物的起始量如下表,反应过程中CO的物质的量浓度随时间变化如图所示。下列说法错误的是( )
CO(g)+H2(g) △H>0,向甲、乙、丙三个恒容容器中加入一定量C和H2O,各容器中温度、反应物的起始量如下表,反应过程中CO的物质的量浓度随时间变化如图所示。下列说法错误的是( )
容器 | 甲 | 乙 | 丙 |
容积 | 0.5 L | 0.5 L | V |
温度 | T1℃ | T2℃ | T1℃ |
起始量 | 2 molC 1 molH2O | 1 molCO 1 molH2 | 4 molC 2molH2O |
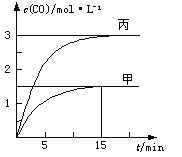
A. 甲容器中,反应在前15 min的平均速率v(H2)=0.1mol·L-1·min-1
B. 丙容器的体积V>0.5 L
C. 当温度为T1℃时,反应的平衡常数K=4.5
D. 乙容器中,若平衡时n(H2O)=0.4 mol,则T2< T1
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关试剂的保存方法,错误的是( )
A.浓硝酸保存在无色玻璃试剂瓶中
B.少量钠保存在煤油中
C.氢氧化钠溶液保存在带有橡皮塞的玻璃试剂瓶中
D.新制氯水通常保存在棕色试剂瓶中
查看答案和解析>>
科目: 来源: 题型:
【题目】下列电离方程式正确的是( )
A.KCl=K++Cl-B.MgCl2=Mg2++Cl2-
C.KOH=K++O2-+H+D.H2SO4=H2++SO42-
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示,U形管内盛有100mL的溶液,按要求回答下列问题: 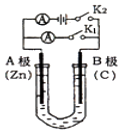
(1)打开K2 , 闭合K1 , 若所盛溶液为CuSO4溶液:则A为极,B极的电极反应式为 . 若所盛溶液为KCl溶液:则B极的电极反应式为 , K+移向极(填A、B)
(2)打开K1 , 闭合K2 , 若所盛溶液为滴有酚酞的NaCl溶液,则: ①A电极附近可观察到的现象是 . 总反应化学方程式是 .
②反应一段时间后打开K2 , 若忽略溶液的体积变化和气体的溶解,B极产生气体的体积(标准状况)为11.2mL,将溶液充分混合,溶液的pH约为 . 若要使电解质溶液恢复到原状态,需向U形管内加入或通入一定量的 .
(3)如要用电解方法精炼粗铜,打开K1 , 闭合K2 , 电解液选用CuSO4溶液,则A电极的材料应换成是 , 反应一段时间后电解质溶液中Cu2+浓度(填“增大”、“减小”、“不变”).
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学学习小组为制取氯气并验证氯气的化学性质,设计了如下实验装置,请按要求回答问题。已知各试剂瓶装的试剂为:B(H2S的水溶液)、C(KI淀粉溶液)、D(FeBr2溶液)、E(混有SO2的BaCl2溶液)、F(水)、H(紫色石蕊溶液)

(1)A是氯气发生装置,其化学反应方程式是________________________________。
(2)Ⅰ中b瓶内加入的液体最好是________。
(3)B中产生淡黄色的单质硫沉淀,请写出反应的化学方程式:______________________
(4)C中的实验现象为______________________
(5)D中的实验现象为______________________
(6)E中产生白色沉淀,共发生了两个反应,请写出发生的氧化还原反应的离子方程式:____________________________________
(7)G装置的硬质玻璃管内盛有炭粉,发生氧化还原反应,其产物为二氧化碳和氯化氢。请写出G中发生反应的化学方程式:_____________________________________。
(8)H中的实验现象为____________________________________________,其原因是___________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】研究PM 2.5、SO2、NOx等,对监测空气质量具有重要意义.取某样本用蒸馏水处理制成待测液,其中所含离子的化学组分及其浓度如下表:
离子 | K+ | Na+ | NH4+ | H+ | SO42﹣ | NO3﹣ | Cl﹣ |
浓度/molL﹣1 | 4×10﹣6 | 6×10﹣6 | 2×10﹣5 | a | 2×10﹣5 | 3×10﹣5 | 2×10﹣5 |
请回答下列问题:
(1)根据表中数据计算此待测液中c(H+)浓度a为________mol/L.
(2)NOx是汽车尾气中的主要污染物之一.
①汽车发动机工作时的高温会引发N2和O2反应,反应的化学方程式是__________.
②NOx能形成酸雨,由NO2形成酸雨的主要反应是______________(写化学方程式).
(3)为减少SO2的排放,常采取的措施有:
①在燃煤中加入生石灰可以起到固硫的作用,SO2被吸收后转化成一种硫元素的最高价态的化合物,该化合物常作为豆腐生产的原料,它在豆腐生产中的作用是___________.
②吸收烟气中的SO2,以下物质可作吸收剂的是_______(填序号);
a.NaOH b.H2SO4 c.NaHSO3 d. Na2SO3
硫酸工业中的尾气SO2可以循环利用,写出SO2转化为SO3反应的化学方程式_______.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com