
科目: 来源: 题型:
【题目】还原铁粉是化工生产及实验室中常用的还原剂。工业上以绿矾为原料制备还原铁粉的工艺如下:
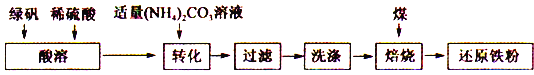
回答下列问题:
(1)酸溶过程中硫酸的作用是________________________ 。
(2)转化的目的是制得FeCO3,加液时应将(NH4)2CO3溶液加入到FeSO4中,原因是_____________。
(3)转化过程中温度不超过35℃,原因是___________________________ 。
(4)生成的FeCO3沉淀需充分洗涤,检验洗涤是否完全的方法是___________________ 。
(5)将FeCO3浊液暴露在空气中,固体表面变为红褐色,同时释放出CO2,写出该反应的化学方程式:________________________ 。
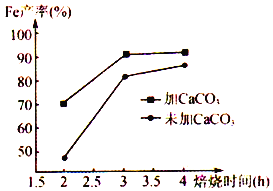
(6)在焙烧过程中需加入CaCO3进行脱硫处理。下图为加CaCO3和不加CaCO3对还原铁粉产率的影响,据图分析CaCO3的另一作用为________________________ 。
查看答案和解析>>
科目: 来源: 题型:
【题目】海水中溴元素以Br形式存在,工业上用空气吹出法从海水中提取溴的工艺流程如图所示:
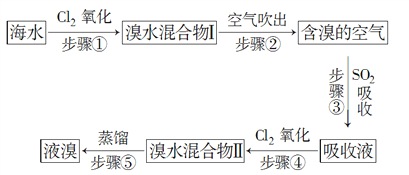
(1)步骤①反应的离子方程式是____________________,步骤③反应的化学方程式是___________________。
(2)从理论上考虑,下列物质也能吸收Br2的是___________(填字母)。
A.NaOH B.FeCl2
C.Na2SO3 D.H2O
(3)步骤③中氧化剂是________,若反应中生成2 mol HBr,则消耗________mol SO2。
(4)根据上述反应判断SO2、Cl2、Br2三种物质氧化性由强到弱的顺序是________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学学习小组设计了如下从海带灼烧后的海带灰中提取碘单质的流程:

(1)溶解海带灰时要加热煮沸2~3min的目的是_________________,操作a的名称为 ____________。
(2)向酸化的溶液I中加入H2O2的目的为__________________________________。
(3)已知I2与40%的NaOH溶液反应生成的氧化产物和还原产物的物质的量之比为1:5,写出对应的化学方程式:________________________________。
(4)最后过滤得到的I2需要进行洗涤和干燥,下列洗涤剂中最应该选用的是_________(填选项字母)。 A.热水 B.乙醇 C.冷水 D.二硫化碳
(5)用Na2S2O3的标准溶液测定产品的纯度,发生反应:I2+2Na2S2O3=Na2S4O6+2NaI。取5.0g产品,配制成100ml溶液。取10.00ml溶液,以淀粉溶液为指示剂,用浓度为0.050mol·L-1Na2S2O3的标准溶液进行滴定,相关数据记录如下表所示。
编号 | 1 | 2 | 3 |
溶液的体积/mL | 10.00 | 10.00 | 10.00 |
消耗Na2S2O3,标准溶液的体积/mL | 19.95 | 17.10 | 20.05 |
滴定时,达到滴定终点的现象是________________,碘单质在产品中的质量分数是________________(用百分数表示,且保留1位小数)。
查看答案和解析>>
科目: 来源: 题型:
【题目】将一定质量的Mg和Al的混合物投入200 ml稀盐酸中,固体全部溶解并产生气体。待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示。则下列说法不正确的是( )
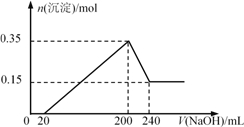
A. Mg和Al的总质量为9g
B. 盐酸的物质的量浓度为5 mol/L
C. NaOH溶液的物质的量浓度为5 mol/L
D. 生成的H2在标准状况下的体积为11.2 L
查看答案和解析>>
科目: 来源: 题型:
【题目】六种短周期元素在元素周期表中的相对位置如图所示,其中R元素的最外层电子数是其次外层电子数的一半。

请回答下列问题:
(1)R的元素名称是_______,中子数为8的X元素的原子是______(用原子组成符号表示)。
(2)上述六种元素,非金属性最强的元素为________________(填元素符号)
(3)Z的最高价氧化物对应水化物的化学式为____________________。
(4)W和Y形成一种二元化合物甲的相对分子质量为184,且Y的质量分数约为30%。则化合物甲的化学式为__________________。化合物甲在摩擦时会发生猛烈爆炸,分解为一种W的单质和一种Y的单质,其中W的单质与Y的单质的相对分子质量之比为64∶7。写出化合物甲爆炸分解的化学方程式:__________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】一定量的CO2与足量的碳在体积可变的恒压密闭容器中反应:C(s)+CO2(g)2CO(g),平衡时,体系中气体体积分数与温度的关系如图所示:已知气体分压(P分)=气体总压(P总)×体积分数,下列说法正确的是( ) 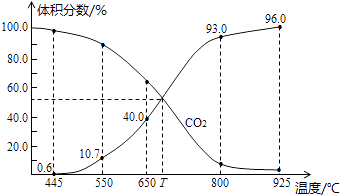
A.550℃时,若充入惰性气体,v正 , v退均减小,平衡不移动
B.650℃时,反应达平衡后CO2的转化率为25.0%
C.T℃时,若充入等体积的CO2和CO,平衡向逆反应方向移动
D.925℃时,用平衡分压代替平衡浓度表示的化学平衡常数Kp=24.0P总
查看答案和解析>>
科目: 来源: 题型:
【题目】在25℃时,将两个铂电极插入一定量饱和Na2SO4溶液中进行电解,通电一段时间后,在阳极上放出a mol气体,同时有w g Na2SO410H2O晶体析出.若温度不变,此时剩余溶液中溶质的质量分数为( )
A.![]() ×100%
×100%
B.![]() ×100%
×100%
C.![]() ×100%
×100%
D.![]() ×100%
×100%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com