
科目: 来源: 题型:
【题目】下列关于硫及含硫化合物的叙述正确的是( )
A.SO2的漂白原理与次氯酸相同B.浓硫酸可以干燥H2、NH3、CO2等气体
C.浓硫酸具有吸水性,能使pH试纸变黑D.硫与铜在加热条件下反应生成Cu2S
查看答案和解析>>
科目: 来源: 题型:
【题目】在一定条件下,A、B反应生成C和D,在2L的密闭容器中进行,起始时加入了4molA和2molB,经过一段时间达到反应限度,测得C的浓度为1mol/L,D的平均反应速率为0.2 mol·L-·min-,A与B都反应了50%,且D与A的化学计量数相同,请回答下列问题:
(1)达到反应限度这段时间内A的反应速率为______________。
(2)写出该反应的化学方程式:________________________________。
(3)达到化学反应限度所用的时间为_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图X、Y分别是直流电源的两极,通电后发现a极板质量增加,d极板有无色无臭的气体放出,符合这一情况的是( )
选项 | a 极板 | d极板 | X极板 | 乙中溶液 |
A | 锌 | 铜 | 负极 | CuSO4 |
B | 石墨 | 石墨 | 负极 | NaOH |
C | 银 | 铁 | 正极 | AgNO3 |
D | 铜 | 石墨 | 负极 | CuCl2 |
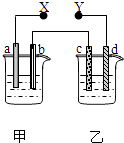
A.A
B.B
C.C
D.D
查看答案和解析>>
科目: 来源: 题型:
【题目】613C-NMR(核磁共振)可以用于含碳化合物的结构分析,613C表示的碳原子( )
A.核外有13个电子B.核内有6个质子,核外有7个电子
C.质量数为13,核内有7个质子D.质量数为13,核内有7个中子
查看答案和解析>>
科目: 来源: 题型:
【题目】某学习小组对浓硫酸与金属锌的反应进行探究。首先按图组装好实验装置,然后取20mL18.5mo/L的浓硫酸与一定量Zn反应,微热试管A,实验过程中先观察到C、D中均有气泡产生,D中开始出现浑浊,后浑独消失,随后气泡量逐渐减少,品红溶液褪色,反应较长时间后,C、D中的气泡量又会明显增加。试回答:
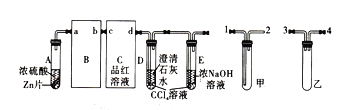
(1)从甲、乙中选择合适的装置填入B、C中,并进行正确连接,a接_____、______接b,c接_____、______接d。
(2)A中产生能使品红溶液褪色的气体的化学方程式为__________________;D、E试管中CCl4溶液的作用是__________。
(3)D中浑浊消失的离子方程式为___________________。
(4)如果锌完全溶解,共生成气体5.6L(标准状况),将反应后的溶液稀释到100mL,测得溶液中H+浓度为0.4mo/L,则反应共消耗锌____g,生成气体的成分及体积之比为_______。
(5)将上述实验中产生的SO2通入酸性高锰酸钾溶液中,高锰酸钾溶液褪色,体现了SO2的___(填“氧化性”“还原性”或“漂白性”),请写出反应的离子方程式____________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】沼气是一种能源,它的主要成分是CH4 . 0.5molCH4完全燃烧生成CO2和H2O(l),放出445kJ热量,则下列热化学方程式中正确的是( )
A.2CH4(g)+4O2(g)═2CO2(g)+4H2O(l)△H═+890 kJ?mol﹣1
B.CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H═+890 kJ?mol﹣1
C.CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H═﹣890 kJ?mol﹣1
D.![]() CH4(g)+O2(g)═
CH4(g)+O2(g)═ ![]() CO2(g)+H2O(l)△H═﹣890 kJ?mol﹣1
CO2(g)+H2O(l)△H═﹣890 kJ?mol﹣1
查看答案和解析>>
科目: 来源: 题型:
【题目】如图为原电池装置示意图。
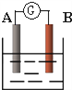
(1)若A为Pb,B为PbO2,电解质溶液为H2SO4溶液,电池的总反应为Pb+PbO2+2H2SO4=2PbSO4+2H2O。则该电池在工作时,A电极的质量将_______(填“增加”、“减小”或“不变”)。若该电池反应消耗了0.1mol H2SO4,则转移电子的数目为_______(设NA为阿伏加德罗常数的值)
(2)若A、B均为铂片,电解质溶液为KOH溶液,分别从A、B两极通入CH4和O2,该电池即为甲烷燃料电池,写出A极的电极反应式:__________________________;该电池工作一段时间后,溶液的碱性将___________(填“增强”、“减弱”或“不变”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学课外兴趣小组为探究铜跟浓硫酸的反应情况,设计了如图所示装置进行有关实验: 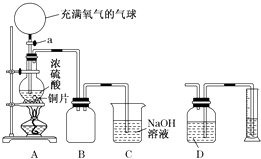
(1)先关闭活塞a,将6.4g铜片和10mL 18mol/L的浓硫酸放在圆底烧瓶中共热至反应完成,发现烧瓶中还有铜片剩余.再打开活塞a,将气球中的氧气缓缓挤入圆底烧瓶,最后铜片完全消失. ①写出上述过程中圆底烧瓶内发生反应的化学方程式:
打开活塞a之前;
打开活塞a之后 .
②B是用来收集实验中产生的气体的装置,但集气瓶内的导管未画全,请直接在图上把导管补充完整.
(2)实际上,在打开活塞a之前硫酸仍有剩余.为定量测定余酸的物质的量,甲、乙两学生进行了如下设计: ①甲学生设计的方案是:先测定铜与浓硫酸反应产生SO2的量,再通过计算确定余酸的物质的量.他测定SO2的方法是将装置A产生的气体缓缓通过装置D,从而测出装置A产生气体的体积(已折算成标准状况下).你认为甲学生设计的实验方案中D装置中的试剂为(填化学式).
②乙学生设计的方案是:将反应后的溶液冷却后全部移入到烧杯中稀释,并按正确操作配制100mL溶液,再取20mL于锥形瓶中,用作指示剂,用标准氢氧化钠溶液进行滴定[已知:Cu(OH)2开始沉淀的pH约为5],选择该指示剂的理由为;再求出余酸的物质的量,若耗去a mol/L氢氧化钠溶液b mL,则原余酸的物质的量为mol(用含a、b的表达式来表示).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com