
科目: 来源: 题型:
【题目】下列关于物质分类的正确组合是( )
分类组合 | 碱 | 酸 | 盐 | 碱性氧化物 | 酸性氧化物 |
A | Na2SO3 | H2SO4 | NaHCO3 | SO2 | CO2 |
B | NaOH | HCl | NaCl | Na2O | NO |
C | NaOH | CH3COOH | CaF2 | CO2 | SO2 |
D | KOH | HNO3 | CaCO3 | CaO | SO2 |
A.AB.BC.CD.D
查看答案和解析>>
科目: 来源: 题型:
【题目】一定温度下,向10 mL H2O2溶液中加入适量FeCl3溶液,反应分两步进行:
①2Fe3++ H2O2=2Fe2++ O2↑+ 2H+,② H2O2 + 2Fe2+ + 2H+ =2Fe3++2H2O,
反应过程中能量变化如下图所示。下列说法正确的是( )
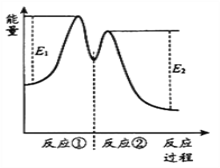
A. 反应②的ΔH=(E2 -E1)kJ·mol-1
B. Fe3+的作用是增大过氧化氢的分解速率
C. 反应2H2O2(aq)=2H2O(l)+O2(g)的△H<0
D. 反应①是放热反应、反应②是吸热反应
查看答案和解析>>
科目: 来源: 题型:
【题目】下列离子方程式正确的是( )
A. 用氢氧化钠溶液吸收NO2 :2OH- + 2NO2=NO2-+ NO3-+ H2O
B. 实验室用浓盐酸与MnO2反应制Cl2:MnO2+2H++2Cl-![]() Mn2++Cl2↑+H2O
Mn2++Cl2↑+H2O
C. 向NaAlO2溶液中通入过量CO2:2AlO2-+ CO2 + 3H2O=2Al(OH)3↓ + CO32-
D. 向明矾溶液中滴加氢氧化钡溶液,使SO42-恰好沉淀完全Al3++ 2SO42-+ 2Ba2++ 4OH-= 2BaSO4↓+ AlO2-+ 2H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)按已知的原子结构规律,27号元素在周期表中的位置是____________,其价电子的轨道排布图为_____________________________。
(2)若en代表乙二胺(![]() ),则配合物[Pt(en)2]Cl4中心离子的配位原子数为____________。
),则配合物[Pt(en)2]Cl4中心离子的配位原子数为____________。
(3)BeCl2是共价分子,可以以单体、二聚体和多聚体形式存在。它们的结构简式如下,指出Be的杂化轨道类型。
①Cl-Be-Cl ____________。
② ![]() ____________。
____________。
③![]() ___________。
___________。
(4)磷化硼(BP)是一种有价值的耐磨硬涂层材料,这种陶瓷材料可作为金属表面的保护薄膜。它是通过在高温氢气氛围下(>750℃)三溴化硼和三溴化磷反应制得。BP晶胞如图所示。
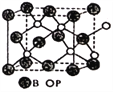
①画出三溴化硼和三溴化磷的空间结构式(必须体现出分子立体结构)。
三溴化硼____________________。
三溴化磷____________________。
②在BP晶胞中B的堆积方式为____________。
③计算当晶胞参数为478pm(即图中立方体的每条边长为478pm)时磷化硼中硼原子和磷原子之间的最近距离____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】向200mL Fe2(SO4)3和CuSO4的混合溶液中逐渐加入铁粉,充分反应后溶液中固体剩余物的质量与加入铁粉的质量如图所示。忽略溶液体积的变化,下列说法正确的是( )

A. a点时溶液中发生的反应为:Fe+2Fe3+=3Fe2+
B. b点时溶液中固体剩余物为Fe和Cu
C. c点时溶液中溶质的物质的量浓度为0.25 mol·L-1
D. 原溶液中Fe2(SO4)3和CuSO4的物质的量浓度之比为1∶1
查看答案和解析>>
科目: 来源: 题型:
【题目】中药狼把草的成分之一M具有消炎杀菌作用,M的结构如图所示,下列叙述正确的是( ) 
A.M的相对分子质量是180
B.1mol M最多能与2mol Br2发生反应
C.M与足量的NaOH溶液发生反应时,所得有机产物的化学式为C9H4O5Na4
D.1mol M与足量NaHCO3反应能生成2mol CO2
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法不正确的是( )
A.纳米材料是指一种称为“纳米”的新物质制成的材料
B.复合材料一般有强度高、质量轻、耐高温、耐腐蚀等优异性能,其综合性质超过了单一材料
C.淀粉和纤维素通式都是(C6H10O5)n , 都是天然高分子化合物
D.合成纤维的主要原料是石油、天然气、煤等
查看答案和解析>>
科目: 来源: 题型:
【题目】铋是一种绿色稀有金属,铋及其化合物在工业生产中用途广泛,工业上常采用粗铋精炼制得用途更为广泛的精炼铋(含铋99.995%),火法精炼铋的工艺流程如下:

已知:①粗铋(铅铋合金)的主要化学成分如下表:
元素 | Ag | Bi | Pb | As | Sb |
含量/% | 0.90 | 55.25 | 27 | 1.30 | 11 |
②氯化铅熔点为498℃,密度为5.9g/cm3;铋的熔点为271℃,沸点为1470℃;BiCl3的熔点为506.5℃。
③锌酸盐简写成ZnO22-,如锌酸钠Na2ZnO2。
④+3价铋的化合物较为稳定,铋酸钠难溶于水。
回答下列问题:
(1)实验室中升温熔化粗铋一般用酒精喷灯在________(填主要仪器名称)中完成。
(2)NaBiO3中铋元素的化合价为________。
(3)“氧化除砷锑”的工艺机理是粗铋熔融液在680~750℃的条件下,鼓入压缩空气,使砷、锑氧化挥发,同时空气也与铋液反应,利用Bi2O3的_______性将杂质砷、锑转变成As2O3、Sb2O3而除去。
(4)“氯化除铅”过程中,氯气与铅、铋反应分别生成PbCl2、BiCl3,生成的BiCl3又会被铅还原,发生反应3Pb+2BiCl3=3PbC12+2Bi,控制温度350-400℃,利用熔点和密度特点,氯化铅上浮至铋液表面呈_______态覆盖,防止氯气__________________。
(5)高温精炼的实质为碱性精炼,加入少量KNO3和NaOH,将锌氧化成锌酸盐而除去残锌,同时得到氮气,写出高温精炼的化学方程式: __________________。
(6)向含有MnSO4的酸性溶液中加入铋酸钠粉末,溶液变为紫红色,该反应经常用来检验Mn2+,写出该反应的离子方程式__________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】BaCl2xH2O是用途广泛的基础化工产品。我国目前主要是用盐酸和硫化钡(含少量Mg2+、Fe3+等)反应生产BaCl2xH2O,工艺流程如下图所示。
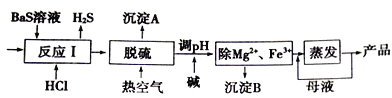
已知: 室温时Ksp[Mg(OH)2]= 1.8×10-11,Ksp[Fe(OH)3]=4.0×10-38,请回答下列问题:
(1)写出氯化钡的电子式______,盐酸和硫化钡反应的化学方程式为___________。
(2)反应I中生成的H2S用足量氨水吸收,一定条件下向所得溶液中通入空气,可得到单质硫并使吸收液再生,吸收液再生反应的化学方程式为_______________________。
(3)沉淀A的成分是__________。
(4)热空气吹除时会有部分HS-转变为S2O32-,使产品仍达不到纯度要求,可再进行酸化脱硫,酸化脱硫时的离子方程式为________________。
(5)室温时,若加碱调溶液pH至9,则完全沉淀的离子是_____________(写出计算过程)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com