
科目: 来源: 题型:
【题目】实验室制取乙烯并检验乙烯性质的装置如图. 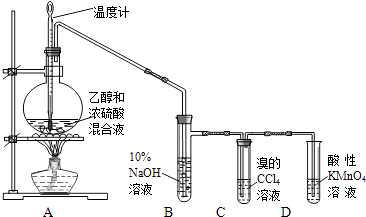
请回答有关问题:
(1)烧瓶中除反应物以外,还应放2﹣3块碎瓷片,目的是 .
(2)烧瓶中产生乙烯的反应方程式为 .
(3)反应开始后,可观察到C和D中共同的现象是;
C中的反应类型为反应、D中的反应类型为反应.
(4)反应结束冷却至室温,处理烧瓶中废液发现,反应液变黑、且有强烈的刺激性气味气体,其原因是;10%的NaOH溶液起的作用是 .
查看答案和解析>>
科目: 来源: 题型:
【题目】短周期元素甲、乙、丙、丁、戊、己、庚在周期表中的相对位置如图(甲不一定在丁、庚的连线上),戊、己分别是空气、地壳中含量最多的元素。下列判断正确的是

A. 甲一定是金属元素
B. 气态氢化物的稳定性:庚>己>戊
C. 乙、丙、丁的最高价氧化物水化物可以以相互反应
D. 庚的最高价氧化物水化物酸性最强
查看答案和解析>>
科目: 来源: 题型:
【题目】乙二酸﹣1,4﹣环己二醇酯可以通过下列路线合成.请回答下列问题: 
(1)上述反应①﹣④中,属于取代反应的有(填序号);
反应⑥﹣⑧中,属于加成反应的有(填序号).
(2)写出下列物质的结构简式:B , C .
(3)写出下列反应的方程式:
反应②:;
反应⑦: .
查看答案和解析>>
科目: 来源: 题型:
【题目】常见元素X、Y、Z 组成的四种物质甲、乙、丙、丁,它们之间能发生反应:甲+乙→丙+丁,其中甲是由X 元素和Z 元素组成的化合物,乙是由Y 元素和Z 元素组成的化合物,丙只含Z 元素。
(1)若甲为淡黄色固体,乙和丙均为常温下的无色无味气体。则甲的电子式为__________;上述反应在标准状况下生成 5.6L 丙时,转移的电子数为__________; 常温下丁溶液pH_____7(填“>”、“<”或“=”),用离子方程式解释_________________________________。
(2)若丙是淡黄色固体,不溶于水也不和水反应。则上述反应的化学方程式是__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】亚硝酸钠(NaNO2)是重要的防腐剂。某实验小组以如图所示的装置和试剂,通过反应制备亚硝酸钠 (部分夹持装置略)。
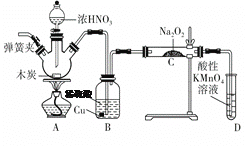
已知:室温下,①2NO+Na2O2===2NaNO2;
②酸性条件下,NO或NO2都能与MnO4-反应生成NO3-和Mn2+。
完成下列填空:
(1)写出A中三种主要玻璃仪器的名称 __________ ,___________,_________。
(2)写出浓硝酸与木炭反应的化学方程式:_______________________。
(3)B中观察到的主要现象是有无色气体产生和______________,D装置的作用是___________________________。
(4)经检验C产物中除亚硝酸钠外还含有副产物碳酸钠和氢氧化钠,为避免产生这些副产物,应在B、C装置间增加装置,则该装置中盛放的药品名称是________。
(5)若NO2可以全部转化成NO,将1.56 g过氧化钠完全转化成为亚硝酸钠,理论上至少需要木炭________g。
查看答案和解析>>
科目: 来源: 题型:
【题目】I.实验室用50 mL 0.50mol/L盐酸、50mL 0.55 mol/LNaOH溶液和如图所示装置,进行测定中和热的实验,得到表中的数据:

实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | |
盐酸 | NaOH溶液 | ||
1 | 20.2 | 20.3 | 23.7 |
2 | 20.3 | 20.5 | 23.8 |
3 | 21.5 | 21.6 | 24.9 |
完成下列问题:
(1)图中实验装置中尚缺少的玻璃仪器是____________________________.
(2)在操作正确的前提下,提高中和热测定准确性的关键是________________________.
(3)根据上表中所测数据进行计算,则该实验测得的中和热△H=_________[盐酸和NaOH溶液的密度按1g/cm3计算,反应后混合溶液的比热容(c)按4.18J/(g·℃)计算].
(4)如用0.5 mol/L的盐酸与NaOH固体进行实验,则实验中测得的“中和热”数值将_____(填“偏大”、“偏小”、“不变”).如改用60 mL0.5moI/L的盐酸与50 mL 0.55mol/L的NaOH溶液进行反应,与上述实验相比,所放出的热量______(填“相等”或“不相等”),所求中和热_____(填“相等”或“不相等”)。
(5) 上述实验结果数值与57.3相比有偏差,产生偏差的原因可能是(填字母)______.
A.测量盐酸的温度后,温度计没有用水冲洗干净
B. 把量筒中的氢氧化钠溶液倒入小烧杯时动作迟缓
C.做本实验的当天室温较高
D.在量取NaOH溶液时仰视计数
E.大烧杯的盖扳中间小孔太大。
Ⅱ.某小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究“外界条件对化学反应速率的影响”。实验时,先分别量取两种溶液,然后倒入试管中迅速振荡混合均匀,开始计时,通过褪色所需时间来判断反应的快慢。该小组设计了如下方案:

(1)已知反应后H2C2O4转化为CO2逸出,KMnO4转化为MnSO4,为了观察到紫色褪去,H2C2O4与KMnO4初始的物质的量需要满足的关系为n(H2C2O4):n(KMnO4) ≥_______。
(2)试验编号②和③探究的内容是_____________。
(3)实验①测得KMnO4溶液的褪色时间为40s,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率v(KMnO4)=__________mol·L-1·min-1。
查看答案和解析>>
科目: 来源: 题型:
【题目】某有机物A由C、H、O三种元素组成,在一定条件下,A、B、C、D、E之间的转化关系如图.已知C的蒸气密度是相同条件下氢气的22倍,并可发生银镜反应. 
写出下列转化的化学方程式.
(1)B变为高分子;
(2)A+O2→C;
(3)A+D→E .
查看答案和解析>>
科目: 来源: 题型:
【题目】有关键能数据如表:
化学键 | Si﹣O | O=O | Si﹣Si |
键能/kJmol﹣1 | X | 498.8 | 176 |
晶体硅的燃烧热为989.2kJmol﹣1 , 则X的值为( )
A.423.3
B.460
C.832
D.920
查看答案和解析>>
科目: 来源: 题型:
【题目】在一定温度时,将1mol A和2mol B放入容积为5L的某密闭容器中发生如下反应:A(s)+2B(g)C(g)+2D(g),经5min后,测得容器内B的浓度减少了0.2mol/L.下列叙述不正确的是( )
A.在5min内该反应用C的浓度变化表示的反应速率为0.2mol/(Lmin)
B.5min时,容器内D的浓度为0.2mol/L
C.当容器内压强保持恒定时,该可逆反应达到平衡状态
D.5min时容器内气体总的物质的量为3mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com