
科目: 来源: 题型:
【题目】胶体区别于其它分散系的本质是()
A. 胶体粒子不能穿过半透膜,能通过滤纸空隙
B. 胶体粒子带电荷并且在一定条件下能稳定存在
C. 胶体的分散质粒子直径在1 nm~100nm之间
D. 胶体粒子能够发生布朗运动而且能产生丁达尔现象
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA为阿伏加罗常数的值,下列叙述正确的是( )
A.标准状况下,33.6L氟化氢中含有氟原子的数目为1.5NA
B.3mol铁与足量的水蒸气充分反应,转移8NA个电子
C.50mL18.4molL﹣1浓硫酸与足量铜微热反应,生成SO2分子的数目为0.46NA
D.某密闭容器盛有0.1molN2和0.3molH2 , 在一定条件下充分反应,转移电子的数目为0.6NA
查看答案和解析>>
科目: 来源: 题型:
【题目】下列反应一定属于放热反应的是( )
①H2SO4 与 Ba(OH)2 溶液的反应 ②Mg 与 CH3COOH 溶液的反应 ③燃烧反应 ④中和反应 ⑤复分解反应
A.仅①②③B.仅①②④
C.仅①②③④D.仅③④⑤
查看答案和解析>>
科目: 来源: 题型:
【题目】下列离子方程式书写正确的是
A. 铁和稀硫酸反应:2Fe+6H+=2Fe3++3H2↑
B. 碳酸钙与稀盐酸反应:CaCO3+2H+=Ca2++CO2↑+H2O
C. 铜和硝酸银溶液反应:Cu+Ag+=Cu2++Ag
D. 硫酸镁溶液与氢氧化钡溶液反应:Mg2++2OH-=Mg(OH)2↓
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关几种常见的金属和非金属及其化合物的说法正确的是( )
A.铝热反应是指铝能将所有的金属从其氧化物中置换出来
B.Na,Mg,Al,Fe,Cu都能导电,它们的氧化物都能与酸反应
C.CO2 , NO,SO2都是非金属氧化物,都属于酸性氧化物
D.CaCO3+SiO2 ![]() ?CaSiO3+CO2↑的发生,说明硅酸的酸性强于碳酸
?CaSiO3+CO2↑的发生,说明硅酸的酸性强于碳酸
查看答案和解析>>
科目: 来源: 题型:
【题目】下列实验方案鉴别Na2CO3和NaHCO3两种白色粉末,不能达到预期目的的是( )
A. 分别向等量的白色粉末中加等体积、等浓度的稀盐酸,比较生成气体的快慢
B. 分别向等量的白色粉末中加等体积适量的水,比较固体溶解量的多少
C. 分别将等量的白色粉末配成溶液,然后加入澄清石灰水,比较是否有沉淀生成
D. 分别将等量的白色粉末用如图装置进行实验,比较澄清石灰水是否变浑浊
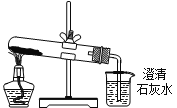
查看答案和解析>>
科目: 来源: 题型:
【题目】H2O2是一种绿色氧化还原试剂,在化学研究中应用广泛.
(1)某化学活动小组拟在同浓度Fe3+的催化下,探究H2O2浓度对H2O2分解反应速率的影响.所用试剂:30%H2O2、0.1molL﹣1Fe2(SO4)3、蒸馏水.
①写出实验中H2O2分解反应方程式: .
②设计实验方案:在不同H2O2浓度下,测定(要求所测得的数据能直接体现反应速率大小).
③根据上述实验要求,请将表格补充完整.
物理量 | 0.1molL﹣1Fe2(SO4)3 | 30% H2O2 | H2O |
1 | 0.5 | 15 | |
2 | 0.5 | 30 | 9.5 |
④查阅资料,30%的H2O2的密度为1.13g/mL,若实验测得实验2中H2O2全部分解所需的时间为2min,则用H2O2表示该反应在2min内的平均速率为(设溶液体积变化忽略不计)
(2)利用图2﹣(a)和(b)中的信息,按图(c)装置(连接的A、B瓶中已充有NO2气体)进行实验.可观察到B瓶中气体颜色比A瓶中的(填“深”或“浅”),其原因是 
查看答案和解析>>
科目: 来源: 题型:
【题目】氯化物在工业生产、日常生活中应用都非常广泛.某学习小组为探究一些实用性很强的氯化物,进行了一系列的资料查询与具体实验.
(1)用于制造电池的原材料二氯亚砜(SOCl2),是一种液态化合物,沸点为77℃.在盛10mL水的锥形瓶中小心滴加8~10滴SOCl2可观察到剧烈反应,液面上形成白雾,并逸出刺激性气味的气体,该气体可使沾有品红试液的滤纸褪色.轻轻振荡锥形瓶,待白雾消失后往溶液中滴加AgNO3溶液,有不溶于稀HNO3的白色沉淀析出.室温下,小组某同学取2.38g SOCl2与水发生上述反应,测得放出热量为17.88kJ.根据以上实验,写出SOCl2与水反应的热化学方程式 .
(2)低温蒸干AlCl3溶液得到固体的主要成分是;小组某同学想制取无水AlCl3固体,他提出可以用AlCl36H2O与SOCl2混合后共热来制取无水AlCl3固体,你认为可行吗?请说明原因 .
(3)TiO2是一种非常好的催化剂.某同学通过查阅资料显示:TiCl4水解程度很大,可以用于TiO2的制备,制备时加入大量的水,同时加热,促进水解趋于完全,所得TiO2xH2O经焙烧得TiO2 . 请写出TiCl4水解的化学方程式
(4)某同学利用NaCl溶液设计实验验证Fe在原电池反应中的生成物,使用Cu电极、Fe电极、经过酸化的3%NaCl溶液,组成原电池装置,实验结束后,该同学往Fe电极区滴入2滴黄色铁氰化钾溶液,现象是: .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com