
科目: 来源: 题型:
【题目】1﹣丁醇和乙酸在浓硫酸作用下,通过酯化反应制得乙酸丁酯,反应温度为115~l25℃,反应装置如图.下列对该实验的描述错误的是( )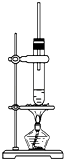
A.不能用水浴加热
B.长玻璃管起冷凝回流作用
C.提纯乙酸丁酯需要经过水、氢氧化钠溶液洗涤
D.加入过量乙酸可以提高1﹣丁醇的转化率
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于细胞中化学元素的叙述,正确的是( )
A. 细胞中一种元素的作用能被其它元素替代
B. 细胞中的脱氧核苷酸和脂肪酸都不含有氮元素
C. 主动运输机制有助于维持细胞内元素组成的相对稳定
D. 细胞中的微量元素因含量极少而不如大量元素重要
查看答案和解析>>
科目: 来源: 题型:
【题目】下图为元素周期表短周期的一部分,Z原子的电子层数为n,最外层电子数为2n+1。下列叙述错误的是 ( )

A. 氢和R、W三种元素形成的阴离子有3种以上
B. RY2分子中每个原子的最外层均为8电子结构
C. R、Y、Z的最高价氧化物对应水化物的酸性依次增强
D. X、Z的氢化物的热稳定性和还原性,都依次减弱
查看答案和解析>>
科目: 来源: 题型:
【题目】下列实验操作错误的是( )
A. 可用托盘天平和小烧杯称取 10.2 g NaOH固体
B. 某实验需要 900 mL 0.1 mol/L的硫酸铜溶液,则配制该溶液需称取 22.5 g 胆矾晶体
C. 用 10 mL 量筒量取 5.2 mL 硫酸,仰视时实际量得的液体体积大于 5.2 mL
D. 在配制一定物质的量浓度溶液的定容步骤时,俯视凹液面,所配溶液浓度偏高
查看答案和解析>>
科目: 来源: 题型:
【题目】某有机物X的结构简式如图所示.若1mol X分别与H2 , Na,NaOH,NaHCO3恰好完全反应,则消耗H2 , Na,NaOH,NaHCO3的物质的量之比为( ) 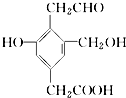
A.4:3:2:1
B.3:3:2:1
C.4:3:2:2
D.3:3:2:2
查看答案和解析>>
科目: 来源: 题型:
【题目】某课外活动小组的同学,在实验室做锌与浓硫酸反应的实验中,甲同学认为产生的气体是二氧化硫,而乙同学认为除二氧化硫气体外,还可能产生氢气。为了验证哪位同学的判断正确,丙同学设计了如图所示实验装置(锌与浓硫酸共热时产生的气体为X,气体发生装置略去)。试回答:
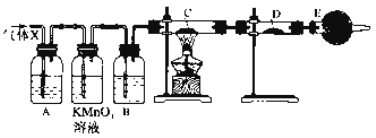
(1)上述反应中生成二氧化硫的化学方程式为__________________。
(2)乙同学认为还可能产生氢气的理由是__________________。
(3)丙同学在安装好装置后,必须首先进行的一步操作是:_________________。
(4)A中加入的试剂可能是________,作用是__________________;
B中加入的试剂可能是________,作用是__________________;
E中加入的试剂可能是________,作用是____________________。
(5)可以证明气体X中含有氢气的实验现象是:C中:________,D中:________。如果去掉装置B,还能否根据D中的现象判断气体X中有氢气?________(填“能”或“不能”),原因是________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、C、D、E是核电荷数依次增大的五种短周期主族元素,A元素的原子核内只有1个质子;B元素的原子半径是其所在主族中最小的,B的最高价氧化物对应水化物的化学式为HBO3;C元素原子的最外层电子数比次外层多4;C的阴离子与D的阳离子具有相同的电子排布,两元素可形成化合物D2C;C、E同主族。
(1)E元素形成的氧化物对应的水化物的化学式为_______________________________。
(2)元素C、D、E形成的简单离子半径大小关系是____________(用离子符号表示)。
(3)用电子式表示化合物D2C的形成过程:_________________。C、D还可形成化合物D2C2,D2C2中含有的化学键类型是_______________________________________________。
(4)由A、B、C三种元素形成的离子化合物的化学式为__________________,它与强碱溶液共热,发生反应的离子方程式是______________________。
(5)某一反应体系中含有D2E、D2EC3、D2EC4三种物质,若此反应为分解反应,则此反应的化学方程式为________________________(化学式用具体的元素符号表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】某学习小组用下图装置研究Cl2的性质。
| 序号 | X | 实验现象 |
Ⅰ | AgNO3溶液 | 现象a | |
Ⅱ | 淀粉碘化钾溶液 | 溶液变蓝 | |
Ⅲ | 紫色石蕊溶液 | 溶液先变红后褪色 | |
Ⅳ | Na2SO3溶液 | 无明显现象 |
请回答:
(1)实验Ⅰ中,现象a是______。
(2)根据实验Ⅱ,推断Cl2的化学性质是______。
(3)根据实验Ⅲ,结合化学方程式说明产生现象的原因:______。
(4)实验Ⅳ中无现象,如何证明反应发生了,简述实验方案______。
(5)结合离子方程式说明实验中NaOH溶液的作用是______。
查看答案和解析>>
科目: 来源: 题型:
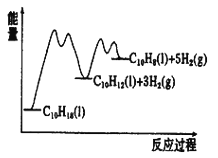
【题目】(一)十氢萘是具有高储氢密度的氢能载体,经历“十氢萘(C10H18)→四氢萘(C10H12)→萘(C10H8)”的脱氢过程释放氢气。已知:ΔH1>ΔH2>0
C10H18(l)![]() C10H12(l)+3H2(g) ΔH1
C10H12(l)+3H2(g) ΔH1
C10H12(l)![]() C10H8(l)+2H2(g) ΔH2
C10H8(l)+2H2(g) ΔH2
请回答:
(1)则C10H8(l)+5H2(g)![]() C10H18(l) ΔH3=___________。
C10H18(l) ΔH3=___________。
(2)有利于提高上述反应平衡转化率的条件是:___________。
A.高温高压 B.低温低压 C.高温低压 D.低温高压
(3)研究表明,将适量十氢萘置于恒容密闭反应器中,升高温度带来高压,该条件下也可显著释氢,理由是:_______________________________。
(4)温度335℃时,在恒容密闭反应器中进行高压液态十氢萘(1.00mol)催化脱氢实验,测得C10H12和C10H8的产率x1和x2(以物质的量分数计)随时间的变化关系,如下图所示。
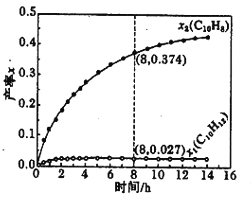
在8h时,反应体系内氢气的量为:_________ mol(忽略其他副反应)。
②已知反应过程中的能量变化如图所示,x1显著低于x2的原因是:_________________________。
(二)科学家发现,以H2O和N2为原料,熔融NaOH—KOH为电解质,纳米Fe2O3作催化剂,在250℃和常压下可实现电化学合成氨。
(5)阴极区发生的变化可视为按两步进行。先发生的电极反应式为:________________________,随后发生反应:2Fe+3H2O+N2==2NH3+Fe2O3。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com