
科目: 来源: 题型:
【题目】下列图示与对应的叙述相符合的是

A. 图甲表示燃料燃烧反应的能量变化
B. 图乙表示酶催化反应的反应速率随反应温度的变化
C. 图丙表示可逆反应从加入反应物开始建立化学平衡的过程
D. 图丁表示将NH3通入醋酸溶液的过程中,溶液导电性的变化
查看答案和解析>>
科目: 来源: 题型:
【题目】下列解释事实的方程式不正确的是( )
A. 金属钠露置在空气中,光亮表面颜色变暗:4Na+O2=2Na2O
B. 硫酸铵溶液与氢氧化钡溶液混合后加热,产生气体:NH4++OH-![]() NH3↑+H2O
NH3↑+H2O
C. 铝条插入烧碱溶液中,开始没有明显现象:Al2O3+2OH-=2AlO2-+H2O
D. 碘化银悬浊液滴加硫化钠溶液,黄色沉淀变成黑色:2AgI+S2-=Ag2S+2I-
查看答案和解析>>
科目: 来源: 题型:
【题目】硫代硫酸钠(Na2S2O3)可由亚硫酸钠和硫粉通过化合反应制得,反应原理为:
①Na2CO3+SO2=Na2SO3+CO2
②Na2S+SO2+H2O=Na2SO3+H2S
③2H2S+SO2=3S↓+2H2O
④Na2SO3+ S ![]() Na2S2O3,
Na2S2O3,
常温下溶液中析出晶体为Na2S2O35H2O。Na2S2O3·5H2O于40~45℃熔化,48℃分解;Na2S2O3 易溶于水,不溶于乙醇。在水中有关物质的溶解度曲线如图所示。

Ⅰ.现按如下方法制备Na2S2O3·5H2O:
将硫化钠和碳酸钠按反应要求比例一并放入三颈烧瓶中,注入150mL蒸馏水使其溶解,在分液漏斗中,注入浓盐酸,在装置2中加入亚硫酸钠固体,并按下图安装好装置。
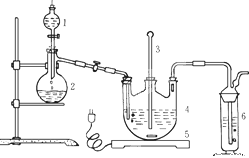
请问:(1)仪器2的名称为________,装置6中可放入_________。
A.BaCl2溶液 B.浓H2SO4
C.酸性KMnO4溶液 D.NaOH溶液
(2)打开分液漏斗活塞,注入浓盐酸使反应产生的二氧化硫气体较均匀的通入Na2S和Na2CO3的混合溶液中,并用磁力搅拌器搅动并加热。随着二氧化硫气体的通入,看到溶液中有大量浅黄色固体析出。持续通二氧化硫气体,反应约半小时。当溶液中pH接近或不小于7时,即可停止通气和加热。溶液pH要控制不小于7理由是________(用离子方程式表示)。
Ⅱ.分离Na2S2O3·5H2O并标定溶液的浓度:

(1)为减少产品的损失,操作①为______,操作②是_____、洗涤、干燥,其中洗涤操作是用_________(填试剂)作洗涤剂。
(2)蒸发浓缩滤液直至溶液呈微黄色浑浊为止,蒸发时为什么要控制温度不宜过高_______。
(3)称取一定质量的产品配制成硫代硫酸钠溶液,并用间接碘量法标定该溶液的浓度:用分析天平准确称取基准物质K2Cr2O7(摩尔质量294g/mol)0.5880克。平均分成3份分别放入3个锥形瓶中,加水配成溶液,并加入过量的KI并酸化,发生下列反应:![]() 6I-+Cr2O72-+14H+=3I2+2Cr3++7H2O,再加入几滴淀粉溶液,立即用所配Na2S2O3溶液滴定,发生反应: I2+2S2O32-=2I-+S4O62-,滴定终点的现象为_____________________。三次消耗Na2S2O3溶液的平均体积为20.00mL,则所标定的硫代硫酸钠溶液的浓度为_________ mol/L。
6I-+Cr2O72-+14H+=3I2+2Cr3++7H2O,再加入几滴淀粉溶液,立即用所配Na2S2O3溶液滴定,发生反应: I2+2S2O32-=2I-+S4O62-,滴定终点的现象为_____________________。三次消耗Na2S2O3溶液的平均体积为20.00mL,则所标定的硫代硫酸钠溶液的浓度为_________ mol/L。
查看答案和解析>>
科目: 来源: 题型:
【题目】低碳经济是以低能耗、低污染、低排放为基础的经济模式,低碳经济的概念在中国正迅速从高端概念演变成全社会的行为,在新能源汽车、工业节能等多个领域都大有作为.请运用化学反应原理的相关知识研究碳及其化合物的性质
(1)工业上可利用CO或CO2来制备燃料甲醇.
已知:800℃时,化学反应①、反应②对应的平衡常数分别为2.5、1.0
反应①:2H2(g)+CO(g)CH3OH(g)△H=-90.8kJmol-1
反应②:H2(g)+CO2(g)H2O(g)+CO(g)△H=+41.2kJmol-1
写出用CO2与H2反应制备甲醇的热化学方程式___________.
800℃时该反应的化学平衡常数K的数值为___________.
(2)现将不同量的CO2(g)和H2(g)分别通入到容积为2L的恒容密闭容器中发生反应: CO(g)+H2O(g)CO2(g)+H2(g)ΔH=+41.2KJ/mol,得到如下二组数据:
实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
CO2(g) | H2(g) | H2O(g) | CO2(g) | |||
1 | 900 | 4 | 2 | 1.6 | 2.4 | 2 |
2 | 900 | a | b | c | d | t |
实验2中,若平衡时,CO2(g)的转化率小于H2(g).则a、b必须满足的关系是__________。
若在900℃时,另做一组实验,在此容器中加入10molCO2(g),5molH2,2molCO,5molH2O(g),则此时v正____v 逆(填“<”>“或“=”)。
(3)工业上可通过甲醇羰基化法制取甲酸甲酯,其反应的热化学方程式为:CH3OH(g)+CO(g) ![]() HCOOCH3(g) ΔH=-29.1 kJ·mol-1,科研人员对该反应进行了研究,部分研究结果:
HCOOCH3(g) ΔH=-29.1 kJ·mol-1,科研人员对该反应进行了研究,部分研究结果:

①从反应压强对甲醇转化率的影响“效率”看,工业制取甲酸甲酯应选择的压强是________。 (填“3.5×106 Pa”、 “4.0×106 Pa”或““5.0×106 Pa”)。
②实际工业生产中采用的温度是80℃,其理由是_________________。
(4)常温下,向20.0mLcmol/L的氨水中滴加20mL.0.2mol/LHNO3溶液后,恰好使溶液显中性(设混合溶液总体积为两溶液体积之和)。计算常温下NH3·H2O![]() NH4++OH-的电离平衡常数K(NH3·H2O)=_________(用含c的式子表示)。
NH4++OH-的电离平衡常数K(NH3·H2O)=_________(用含c的式子表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】某温度下,H2(g)+CO2 (g)H2O(g)+CO(g)的平衡常数K= ![]() ,该温度下在甲、乙、丙三个恒容密闭容器中,投入H2 (g)和CO2 (g),其起始浓度如表所示,下列判断不正确的是( )
,该温度下在甲、乙、丙三个恒容密闭容器中,投入H2 (g)和CO2 (g),其起始浓度如表所示,下列判断不正确的是( )
起始浓度 | 甲 | 乙 | 丙 |
c(H2)/molL﹣1 | 0.010 | 0.020 | 0.020 |
c(CO2)/molL﹣1 | 0.010 | 0.010 | 0.020 |
A.平衡时,乙中CO2的转化率大于60%
B.平衡时,甲中和丙中H2的转化率均是60%
C.平衡时,丙中c(CO2)是甲中的2倍,是0.008 molL﹣1
D.反应开始时,乙中的反应速率最快,甲中的反应速率最慢
查看答案和解析>>
科目: 来源: 题型:
【题目】某芳香烃X(相对分子质量为92)是一种重要的有机化工原料,研究部门以它为初始原料设计出如下转化关系图(部分产物、合成路线、反应条件略去).其中A是一氯代物,H是一种功能高分子,链节组成为C7H5NO. 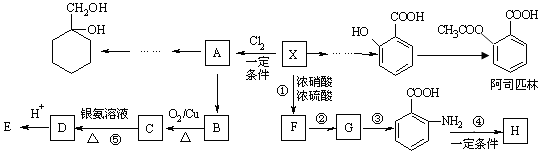
已知: ![]()
(1)F的结构简式是 , 反应①~⑤中属于取代反应的有 .
(2)反应②③两步能否互换(填“能”或“不能”),理由是 .
(3)B→C的化学方程式是 .
(4)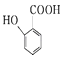 有多种同分异构体,请写出符合下列条件的同分异构体的结构简式(任写一种) ①能发生银镜反应
有多种同分异构体,请写出符合下列条件的同分异构体的结构简式(任写一种) ①能发生银镜反应
②含有苯环且分子中有四种不同化学环境的氢原子
③1mol该有机物最多能与2molNaOH反应.
(5)请用合成反应流程图表示出由 ![]() 和其他无机试剂合成
和其他无机试剂合成 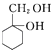 最合理的方案. 示例:H2C=CH2
最合理的方案. 示例:H2C=CH2 ![]() CH3CH2Br
CH3CH2Br ![]() CH3CH2OH.
CH3CH2OH.
查看答案和解析>>
科目: 来源: 题型:
【题目】把6molA气体和5molB气体混合放入4L密闭容器中,在一定条件下发生反应:3A (g)+B(g)2C(g)+xD(g),经5min达到平衡,此时生成C为2mol,测定D的平均反应速率为0.1mol/(Lmin),下列说法错误的是( )
A.x=2
B.B的转化率为20%
C.平衡时A的浓度为0.75mol/L
D.恒温达平衡时容器内的压强为开始时的85%
查看答案和解析>>
科目: 来源: 题型:
【题目】氯化亚铜是白色粉末,微溶于水,不溶于乙醇,在空气中会被迅速氧化成绿色碱式盐。从酸性电镀废液(主要含Cu2+、Fe3+)中制备氯化亚铜的工艺流程图如下:
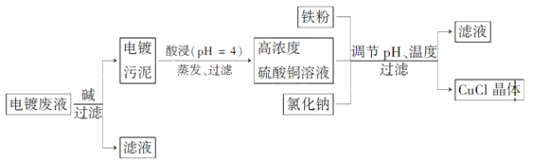
金属离子含量与混合液pH、CuCl产率与混合液pH的关系图如图。
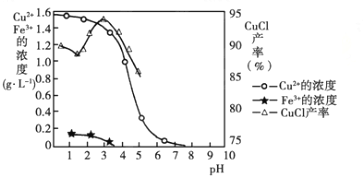
【已知:金属离子浓度为1 mol·L-1时,Fe(OH)3开始沉淀和沉淀完全的pH分别为1.4和3.0,Cu(OH)2开始沉淀和沉淀完全的pH分别为4.2和6.7】
请回答下列问题:
(1)酸浸时发生反应的离子方程式是________;析出CuCl晶体时的最佳pH在_______左右。
(2)铁粉、氯化钠、硫酸铜在溶液中反应生成CuCl的离子反应方程式为________________。
(3)析出的CuCl晶体要立即用无水乙醇洗涤,在真空干燥机内于70℃干燥2 h、冷却密封包装。70℃真空干燥、密封包装的目的是_____________。
(4)产品滤出时所得滤液的主要分成是________,若想从滤液中获取FeSO4·7H2O晶体,还需要知道的是__________________。
(5)若将铁粉换成亚硫酸钠也可得到氯化亚铜,试写出该反应的化学方程式:______________。为提高CuCl的产率,常在该反应体系中加入稀碱溶液,调节pH至3.5。这样做的目的是_____________。
(6)工业上还可以采用以碳棒为电极电解CuCl2溶液得到CuCl。写出电解CuCl2溶液中的阴极上发生的电极反应:___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com