
科目: 来源: 题型:
【题目】已知C—C单键可以绕键轴旋转,其结构简式可表示为![]() 的烃,下列说法中正确的是( )
的烃,下列说法中正确的是( )
A. 分子中最多有4个碳原子处于同一直线上
B. 该烃的核磁共振氢谱图有四组峰
C. 分子中至少有10个碳原子处于同一平面上
D. 该烃是苯的同系物
查看答案和解析>>
科目: 来源: 题型:
【题目】环境污染已成为人类面临的重大威胁,下列对应关系不正确的是( )
环境问题 | 造成环境问题的主要物质 | |
A | 酸雨 | 二氧化硫 |
B | 温室效应 | 二氧化碳 |
C | 白色污染 | 二氧化硅 |
D | 光化学烟雾 | 二氧化氮 |
A.AB.BC.CD.D
查看答案和解析>>
科目: 来源: 题型:
【题目】下列叙述正确的是( )
A.将稀氨水逐滴加入稀硫酸中,当溶液的pH=7时,c(SO42﹣)>c(NH4+)
B.NaHCO3溶液中:c (CO32﹣)+c(H+)=c(H2CO3)+c(OH﹣)
C.1 L 0.1 molL﹣1CuSO4(NH4)2SO46H2O溶液中:c(SO42﹣)>c(NH4+)>c(Cu2+)>c(H+)>c(OH﹣)
D.向0.1mol/L的氨水中加入少量硫酸铵固体,则溶液中c(OH﹣)/c(NH3H2O)增大
查看答案和解析>>
科目: 来源: 题型:
【题目】一种含铝、锂、钴的新型电子材料,生产中产生的废料数量可观,废料中的铝以金属铝箔的形式存在;钴以Co2O3·CoO的形式存在,吸附在铝箔的单面或双面:锂混杂于其中。(已知Co2O3的氧化性>Cl2的氧化性)从废料中回收氧化钴(CoO)的工艺流程如下:
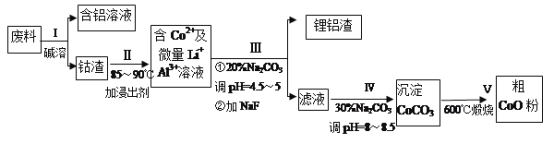
已知:①CoCO3的溶度积为:Ksp=1.0×10-13;
②溶液中离子浓度小于1.0×10-5mol/L时认为该离子沉淀完全。
(1)“碱溶”前通常将废料粉碎,其目的是____________。
(2)过程I中采用NaOH溶液溶出废料中的A1,反应的离子方程式为_________________。
(3)过程Ⅱ中加入稀H2SO4酸化后,再加入Na2S2O3溶液浸出钴。则浸出含钻物质的反应化学方程式为 (产物中只有一种酸根) _______________________________________。在实验室模拟工业生产时,也可用盐酸浸出钴,但实际工业生产中不用盐酸,请分析不用盐酸浸出钴的主要原因______________________________________。
(4)过程III得到锂铝渣的主要成分是LiF和AI(OH)3,碳酸钠溶液在产生 Al(OH)3时起重要作用,请写出该反应的离子方程式__________________________________。
(5)将2.0×10-4 mol/LCoSO4与2.2×10-4mol/L的Na2CO3等体积混合,此时溶液中的Co2+的浓度为__________,Co2+是否沉淀完全? __________(填“是”或“否”)。
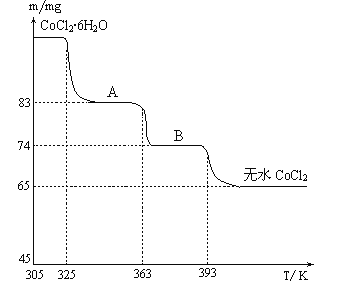
(6)CoO溶于盐酸可得粉红色的CoCl2溶液。CoCl2含结晶水数目不同而呈现不同颜色,利用蓝色的无水CoCl2吸水变色这一性质可制成变色水泥和显隐墨水。如图是粉红色的CoCl2·6H2O晶体受热分解时,剩余固体质量随温度变化的曲线,物质B的化学式是____________________。
【答案】 略 略 略 略 略 略 略 略
【解析】(1). “碱溶”前通常将废料粉碎,可以增大固体反应物的接触面积,加快反应速率,故答案为:增大反应物接触面积,加快反应速率;
(2). NaOH溶液和Al反应生成偏铝酸钠和氢气,离子方程式为:2A1+2OH-+2H2O=2A1O2-+3H2↑,故答案为:2A1+2OH-+2H2O=2A1O2-+3H2↑;
(3). 废料中钴以Co2O3·CoO的形式存在,钴的化合价为+2价和+3价,由流程图可知,加入Na2S2O3溶液后,钴全部变为+2价,说明Co3+氧化S2O32-,还原产物为Co2+,由产物中只有一种酸根离子可知氧化产物为SO42-,根据得失电子守恒和原子守恒,浸出含钴物质的反应化学方程式为:4Co2O3·CoO+Na2S2O3+11H2SO4=12CoSO4+Na2SO4+11H2O,由题中信息可知,Co2O3的氧化性>Cl2的氧化性,则Co2O3·CoO可氧化盐酸产生Cl2,污染环境,所以实际工业生产中不用盐酸浸出含钴物质,故答案为:4Co2O3·CoO+Na2S2O3+11H2SO4=12CoSO4+Na2SO4+11H2O;Co2O3·CoO可氧化盐酸产生Cl2,污染环境;
(4). 在过程III中加入碳酸钠溶液,碳酸根离子和铝离子发生双水解反应生成氢氧化铝沉淀,离子方程式为:2A13++3CO32-+3H2O=2A1(OH)3↓+3CO2↑,故答案为:2A13++3CO32-+3H2O=2A1(OH)3↓+3CO2↑;
(5). 将2.0×10-4mol/LCoSO4与2.2×10-4mol/L的Na2CO3等体积混合,Co2+与CO32-反应生成CoCO3,离子方程式为:Co2++ CO32-= CoCO3,由离子方程式可知,反应后的溶液中c(CO32-)=( 2.2×10-4-2.0×10-4)mol/L÷2=1×10-5mol/L,则反应后的溶液中c(Co2+)=![]() =1.0×10-8mol/L,c(Co2+)<1.0×10-5mol/L,所以Co2+沉淀完全,故答案为:1.0×10-8mol/L;是;
=1.0×10-8mol/L,c(Co2+)<1.0×10-5mol/L,所以Co2+沉淀完全,故答案为:1.0×10-8mol/L;是;
(6). 据图可知,n(CoCl2)=65×10-3g÷130g/mol=5×10-4mol,B中含有水的物质的量为n(H2O)=(74-65)×10-3g÷18g/mol=5×10-4mol,则n(CoCl2): n(H2O)=1:1,则物质B为CoCl2·H2O,故答案为:CoCl2·H2O。
【题型】综span>合题
【结束】
10
【题目】砷元素广泛存在于自然界,砷与其化合物被运用在农药、除草剂、杀虫剂等。
(1)砷的常见氧化物有As2O3和As2O5,其中As2O5热稳定性差。根据图1写出As2O3转化为As2O5的热化学方程式__________________________________。
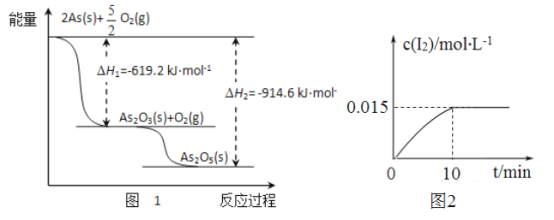
(2)砷酸钠具有氧化性,298K时,在100mL烧杯中加入10mL0.1 mol/L Na3AsO4溶液、20mL0.1 mol/L KI溶液和20mL0.05mol/L硫酸溶液,发生下列反应:AsO43-(无色)+12(浅黄色)+H2O △H。测得溶液中c(I2)与时间(t)的关系如图2所示(溶液体积变化忽略不计)。
①升高温度,溶液中AsO43-的平衡转化率减小,则该反应的△H________0(填“大于”“小于”或“等于”)。
②0~10min内,I的反应速率v(Iˉ)= ____________。
③下列情况表明上述可逆反应达到平衡状态的是_______(填字母代号)。
a.c(AsO33-)+c(AsO42-)不再变化 b.溶液颜色保持不再变化
C.c(AsO33-)与c(AsO42-)的比值保持不再变化 d.I的生成速率等于I2的生成速率
④在该条件下,上述反应平衡常数的表达式K=______________。
(3)利用(2)中反应可测定含As2O3和As2O5的试样中的各组分含量(所含杂质对测定无影响),过程如下:
①将试样02000g溶于NaOH溶液,得到含AO33-和AsO43-的混合溶液。
②上述混合液用0.02500 mol·L-1的I2溶液滴定,用淀粉试液做指示剂,当________________,则滴定达到终点。重复滴定3次,平均消耗I2溶液40.00mL。则试样中As2O5的质量分数是_________(保留四位有效数字)。若滴定终点时,仰视读数,则所测结果_________ (填“偏低”,“偏高”,“无影响”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于甲、乙、丙、丁四中有机物的说法正确的是( )

A. 甲、乙、丙、丁中分别加入氯水,均有红棕色液体生成
B. 甲、乙、丙、丁中加入NaOH溶液共热,然后加入稀硝酸调至溶液呈酸性,再滴入AgNO3溶液,均有沉淀生成
C. 甲、乙、丙、丁中加入NaOH的醇溶液共热,然后加入稀硝酸调至溶液呈酸性,再滴入AgNO3溶液,均有沉淀生成
D. 乙与氢氧化钠醇溶液反应得到两种烯烃
查看答案和解析>>
科目: 来源: 题型:
【题目】井水冒泡、有异味和变浑浊是地震的常见征兆,其中可能涉及地下硫铁矿(FeS2)发 生的反应:FeS2+H2O=Q+S+H2S↑ (已配平),则物质Q是
A. Fe2O3 B. FeO C. Fe(OH)2 D. Fe(OH)3
查看答案和解析>>
科目: 来源: 题型:
【题目】下列化学用语使用正确的是( )
A. 葡萄糖(C6H12O6)、淀粉[(C6H10O5)n]的最简式都是CH2O
B. 乙醇的分子式:C2H5OH
C. 乙醛分子的结构简式是CH3COH
D. 丙烯分子的球棍模型是![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】水污染、水资源短缺导致的水危机日趋严重,研究表明,80%的疾病是由水污染引起的。下列关于细胞中的水,以下说法正确的是
A. 细胞中绝大部分的水以结合水的形式存在
B. 用洁净的试管加热晒干的种子,试管壁上出现的水珠主要来自种子中的自由水
C. 沙漠里的仙人掌,细胞中蛋白质的含量远多于水
D. 细胞中自由水含量增加时,代谢加强,抗逆性减弱
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com