
科目: 来源: 题型:
【题目】某有机物A30g完全燃烧生成44gCO2和18g水。
(1)若A发生如图反应:
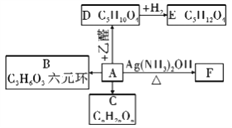
已知:![]() CH3CH=CHCHO
CH3CH=CHCHO
①A中官能团的名称______________;
②请写出物质B的结构简式____________________;
③E可在______________________条件下生成C5H4O4。
(2)若A发如下反应:
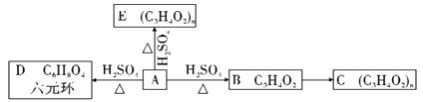
①请写出A生成D的化学反应方程式_______________________________;
②A生成E的反应类型_____________;B生成C的反应类型__________________;
③A的一种同分异构体A1可与A发生类似的反应,不过其生成的D1物质含有八元环。请写出A1的结构简式____________________。
(3)若A发生如下反应:
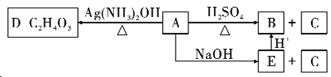
①请写出A的结构简式____________________。
②分子式为C9H18O2的物质M与A属于同一类物质,且可以酸性条件下水解为两种相对质量相同的物质,则符合条件的B的同分异构体有__________种。
查看答案和解析>>
科目: 来源: 题型:
【题目】亚铜的化合物经常具有令人惊奇的化学性质,常见的有CuH、CuCl等。
已知:CuCl熔点为430℃,沸点为1490℃,见光分解,露置于潮湿空气中易被氧化,难溶于水、稀盐酸、乙醇,易溶于浓盐酸生成H3CuCl4,反应的化学方程式为CuCl(白色,s)+3HCl(aq)![]() H3CuCl4(黄色,aq)。经常有两种方法制CuCl:
H3CuCl4(黄色,aq)。经常有两种方法制CuCl:
方法1:次磷酸H3PO2是一种强还原剂,将它加入CuSO4水溶液,加热到40~50℃,析出一种红棕色的难溶物CuH。待CuH生成后将A装置产生的HCl气体通入,可产生CuCl。

(1)写出H3PO2与CuSO4水溶液反应的化学方程式____________________。
(2)A装置中分液漏斗与圆底烧瓶中的物质依次为_________________________。
(3)刚开始通HCl气体时B装置中反应的化学方程式为______________________________。
(4)请描述从开始通HCl气体到通大量HCl气体过程中B装置中的观象_______________。
方法2:实验室用也可用如图所示装置制取CuCl,反应原理为:2Cu2++SO2+8Cl-+2H2O=2CuCl43-+SO42-+4H+
CuCl43-(aq)![]() CuCl(s)+3C1-(aq)
CuCl(s)+3C1-(aq)
装置B中反应结束后,取出混合物进行一系列操作可得到CuCl晶体。
(5)①在反应过程中SO2要过量通入的原因是______________________。
②欲提纯某混有铜粉的CuCl晶体,请简述实验方案:___________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某再回收利用公司对一厨房铁铝合金废旧家具进行回收利用,其流程如下图所示:
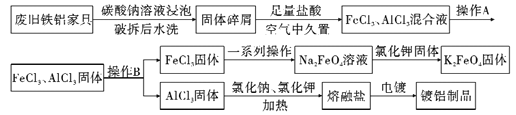
请回答下列问题:
(1)流程中加碳酸钠溶液浸泡的目的是_______________;在空气中久置的目的是_________________。
(2)同条件下Na2FeO4溶解度__________K2FeO4溶解度(填“低于”,“高于”, “不确定”),推测K2FeO4在净水方面的作用_______________。(至少答两条)
(3)已知K2FeO4水解显碱性。在洗涤K2FeO4固体时最好选用__________。
A.水 B.亚硫酸氢钠溶液 C.氢氧化钠溶液 D.先氢氧化钠溶液后乙醇
(4)熔融盐电镀中铝元素和氯元素主要以AlCl4-和Al2Cl7-形式存在,铝电镀的主要电极反应式为___________________。(写出一个电极反应即可)
(5)已知氯化铝受热易升华,气态氯化铝的密度为11.92g/L(已转化为标准状况),则气态氯化铝的分子式为______________________。
(6)氢氧化铝经常用于做药品,有两种溶解方式:可以溶解为Al3+或[Al(OH)4]-。已知25℃时氢氧化铝在pH=3和pH=10的两溶液中溶解度均为7.8×10-3g(溶液密度近似为1g/mL),则25℃下氢氧化铝的两种溶解方式的溶度积之比为____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】能源与材料、信息被称为现代社会发展的三大支柱,化学与能源有着密切联系。
(1)下表中的数据表示破坏1mol化学键需消耗的能量(即键能,单位为kJ·mol-1)
化学键 | H-H | Cl-Cl | H-Cl |
键能 | 436 | 243 | 431 |
请根据以上信息可知,1mol氢气在足量的氯气着燃烧生成氯化氢气体放出热量___________。
(2)天然气是一种重要的情节能源和化工原料,其主要成分为CH4。以CH4、空气、KOH溶液为原料,石墨为电极可构成燃料电池。该电池的负极反应式为___________。
(3)工业上有一种方法是用 CO2来生产燃料甲醇,可以将CO2变废为宝。在体积为1L的密闭容器中,充入1molCO2和3molH2,一定条件下发生反应:CO2+3H2![]() CH3OH(g)+H2O(g),测得CO2(g)和CH3OH(g)的浓度随时间变化如下图所示。
CH3OH(g)+H2O(g),测得CO2(g)和CH3OH(g)的浓度随时间变化如下图所示。

①从反应开始到平衡,CH3OH的平均反应速率v(CH3OH)=___________;H2的转换率α(H2)=___________。
②若反应CO2+3H2![]() CH3OH(g)+H2O(g)在四种不同情况下的反应速率分别为:
CH3OH(g)+H2O(g)在四种不同情况下的反应速率分别为:
A.V(CO2)=0.15mol·L-1·min-1B.V(H2)=0.01mol·L-1·s-1
C.v(CH3OH)=0.2mol·L-1·min-1D.v(H2O)=0.45mol·L-1·min-1
该反应进行由快到慢的顺序为___________(填字母)。
(4)海水化学资源的利用具有非常广阔的前景。从海水中提取溴的工业流程如图:

①流程④中涉及的离子反应如下,请在下面方框内填入适当的化学计量数:
□Br2+□CO32-=□BrO3-+□Br-+□CO2↑______
②以上五个过程中涉及氧化还原反应的有___________个。
③步骤③中已获得游离态的溴,步骤④又将之转变成化合态的溴,其目的是___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】N元素形成的化合物丰富多彩,试回答下列问题:
(1)向硫酸铜溶液中逐滴加入氨水先产生沉淀,后沉淀溶解为深蓝色溶液,加入乙醇会析出蓝色晶体。
①基态铜原子的核外电子排布式为________________;
②1mol该蓝色晶体的阳离子中含有的σ键的数目为___________;
③简要解释为什么加入乙醇会有晶体析出_____________________________;
(2)已知邻羟基苯胺的结构式为![]() ,比较:邻羟基苯胺的沸点_____________对羟基苯胺的沸点(填“低于”, “高于”, “不确定”);毒奶粉事件中的主角是三聚氰胺,结构简式为
,比较:邻羟基苯胺的沸点_____________对羟基苯胺的沸点(填“低于”, “高于”, “不确定”);毒奶粉事件中的主角是三聚氰胺,结构简式为![]() ,该分子中氮原子的杂化方式为________________;复旦投毒案的主角是N一二甲基亚硝胺,结构简式为
,该分子中氮原子的杂化方式为________________;复旦投毒案的主角是N一二甲基亚硝胺,结构简式为![]() ,则该分子所涉及的第二周期元素第一电离能由小到大的顺序为____________________;
,则该分子所涉及的第二周期元素第一电离能由小到大的顺序为____________________;
(3)已知CuN3中的阴离子与CO2互为等电子体,CuN3晶体的晶胞与氯化钠的晶胞类似。
①请写出CuN3中的阴离子的电子式__________________;
②已知该晶体晶胞边长a,b,c,关系为a=b___________个;
(4)已知NH3,NF3,N(CH3)3都可以与铜离子生成配离子。
①稳定性[Cu(NH3)4]2+__________[Cu(NF3)4]2+。(填“低于”, “高于”,“不确定” )
②已知稳定性[Cu(NH3)4]2+高于[Cu[N(CH3)3]4]2+,请简要解释原因_______________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】短周期元素W、X、Y和Z在周期表中的相对位置如下表所示,这四种元素原子的最外层电子数之和为21。请用化学用语回答下列问题:
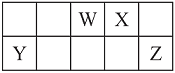
(1)写出W含有8个中子的核素的化学符号_____________。
(2)元素Z的最高价氧化物对应的水化物的化学式为_____________。
(3)在X、Y、Z三种元素中,其离子半径按由大到小的排列顺序为________________。
(4)X、Z的气态氢化物沸点较高是________,原因是____________________。
(5)化合物Y2X3中含有的化学键类型是________。工业上冶炼Y单质的方法是________(填字母)。
A.重力沉降法 B.热分解法 C.热还原法 D.电解法
(6)水中锰含量超标,容易使洁具和衣物染色、使水产生异味。ZX2可以用来除去水中超标的Mn2+,生成一种黑色沉淀,同时测得消耗13.50g ZX2时,共转移了1mol电子,则反应的离子方程式是___________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某无色济液中,只可能含有以下离子中的若干种:NH4+、K+、Mg2+、Cu2+、Al3+、NO3-、CO32-、SO42-,,现取三份100mL溶液进行如下实验:
①第一份加足量AgNO3溶液后,有白色沉淀产生。
②第二份加足量BaCl2溶液后,有白色沉淀产生,经洗涤、干燥后,沉淀质量为6.99g
③第三份逐滴滴加NaOH溶液,测得沉淀与NaOH溶液的体积关系如图。根据上述实验,试回答下列问题:

(1)该溶液中一定不存在的阴离子有_______。
(2)实验③中NaOH溶液滴至35mL后发生的离子方程式为_______________________________。
(3)原得液确定含Mg2+、Al3+、NH4+,且n(Mg2+)∶n(Al3+)∶n(NH4+)=___________。
(4)实验所加的NaOH溶液的浓度为________。
(5)溶液中存在一种不能确定的阳离子,请设计实验方案加以检验_________________________。
(6)原溶液中NO3-的浓度为c(NO3-)则c(NO3-)的最小浓度为_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】在一定温度下,将2.4molA和1.2molB两种气体相混合后于容积为2L的某密闭容器中,发生如下反应A(g)+B(g)x C(g)+D(g)△H<0,2min末反应达到平衡状态,生成了0.8molD,并测得C的浓度为0.4mol/L,请填写下列空白:
(1)x值等于 2min内v(B)= .
(2)A的转化率为 .
(3)该反应达到平衡时,再向容器中加入1.2molA和0.6molB,再次达到平衡后,A的转化率(填“增大”、“减小”或“不变”).
(4)该反应的平衡常数的表达式k= , 450℃时平衡常数500℃时平衡常数(填“大于”、“小于”或“等于”).
(5)相同温度下,若起始时向该容器中充入0.4mol A、0.4mol B、0.2molC和0.2molD,反应达到平衡前,反应速率v正v逆(填“>”或“<”),达到平衡时D的浓度为 .
查看答案和解析>>
科目: 来源: 题型:
【题目】已知甲为恒压容器、乙为恒容容器.相同条件下充入等物质的量的NO2气体,且起始时体积相同.发生反应:2NO2(g)N2O4 (g)△H<0.一段时间后相继达到平衡状态.下列说法中正确的是( )
A.平衡时NO2体积分数:甲<乙
B.达到平衡所需时间,甲与乙相等
C.该反应的平衡常数表达式K=c(N2O4)/c(NO2)
D.若两容器内气体的压强保持不变,均说明反应已达到平衡状态
查看答案和解析>>
科目: 来源: 题型:
【题目】管道工人曾经用浓氨水检测氯气管道是否漏气。某化学兴趣小组利用下图装置探究氯气与氨气之间的反应原理。其中A、F分别为氨气和氯气的发生装置,C为氧气与氨气的反应装置。
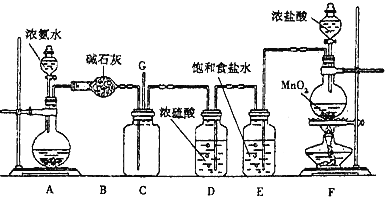
请回答下列问题:
(1)装置A中的烧瓶内固体可以选用______(选填序号).
A.二氧化锰 B.碱石灰 C.五氧化二磷
(2)装置F中发生反应的离子方程式为__________________________________;装置E的作用是______________________________;
(3)通入装置C的两根导管左边较长、右边较短,目的是________________________。
(4)装置C内出现浓厚的白烟并在容器内壁凝结,另一生成物是空气的主要成分之一。请写出反应的化学方程式:_____________________________________________;该反应中,氧化剂与还原剂的物质的量之比为_________。从装置C的G处逸出的尾气中可能含有黄绿色的有毒气体,如何处理?__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com