
科目: 来源: 题型:
【题目】表是元素周期表的一部分,根据所给的10种元素,完成以下各小题..
族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O |
二 | C | N | O | Ne | ||||
三 | Na | Mg | Al | Si | S | Cl |
(1)镁的原子结构示意图为 .
(2)H2SO4与HClO4中,酸性较强的是 .
(3)NaOH与Al (OH)3中,属于两性氢氧化物的是 . 它常用作治疗胃酸(含盐酸)过多的药物,该反应的离子方程式为 .
查看答案和解析>>
科目: 来源: 题型:
【题目】为测定某NaHCO3样品的纯度(杂质为NaCl),进行如下实验:
(1)称取2.000g样品,配成200mL待测液,配制待测液所需定量仪器有;
(2)在锥形瓶中放入20.00mL待测液,滴加2滴甲基橙,摇匀.用0.100mol/L的标准盐酸滴定,边滴边摇动锥形瓶,眼睛注视 . 直到滴入最后一滴盐酸,溶液颜色由色变为色,并在内不发生变化,停止滴定,记录读数.
(3)重复滴定实验1~2次,计算平均消耗盐酸22.60mL.重复实验的目的是 .
(4)所配待测液中NaHCO3的浓度为mol/L;样品中NaHCO3的质量分数为 .
查看答案和解析>>
科目: 来源: 题型:
【题目】下列反应适用于工业生产的是
A.电解熔融氯化铝可得到金属铝B.光照氯气和氢气的混合物生产盐酸
C.氯气与石灰乳作用制漂白粉D.二氧化锰和浓盐酸共热,制取氯气
查看答案和解析>>
科目: 来源: 题型:
【题目】镁、铝在生产生活中有广泛的应用.回答下列问题:
(1)铝的原子结构示意图为 . 它位于元素周期表的第周期,第族.
(2)实验室制备氢氧化铝的常用方法是在氯化铝溶液中滴加氨水,反应的离子方程式为 .
(3)常温下,铁跟水不反应,但红热的铁会跟水蒸气发生反应,反应的化学方程式为 .
(4)检验某溶液中是否含有Fe3+的操作方法是 .
查看答案和解析>>
科目: 来源: 题型:
【题目】用0.100mol/L标准盐酸溶液滴定20mL未知浓度的氢氧化钠溶液,下列操作会造成测定结果偏低的是( )
A.装盐酸的滴定管用蒸馏水洗干净后立即装入盐酸
B.滴加盐酸时滴到锥形瓶外
C.滴定达到终点时,振荡时待测液溅出锥形瓶
D.滴定前装盐酸的滴定管有气泡,滴定后气泡消失
查看答案和解析>>
科目: 来源: 题型:
【题目】镓(Ga)被誉为第三代半导体的明屋元素,广泛应用于电子工业。Ga位于周期表的第四周期,与A1同主族,主要存在Ga3+、GaO2-两种离子形态。
(1)请画出Ga的原子结构示意图___________。
(2)请写出Ga2O3溶解在NaOH溶液中的离子方程式_________________。
(3)氮化镓(GaN)可用于制作蓝色LED光源。GaN的传统工艺是用GaCl3与NH3反应来制备,新工艺则采用金属Ga与NH3在一定条件下来合成。已知:
①GaCl3(s)+NH3(g)=GaN(s)+3HCl(g) H1=+180kJ/mol
②2Ga(s)+6HCl(g)=2GaCl3(s)+3H2(g)H2=-492kJ/mol
③Ga(s)+NH3(g)=GaN(s)+3/2H2(g) H3
由上述反应可知H3=_____________。
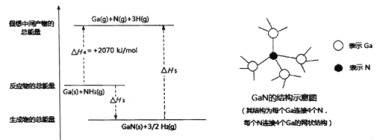
已知H-H的键能为436kJ/mol,结合上图分析,1molGaN含有_____molGa-N键,拆开lmolGa-N键所需能量为______kJ。
(4)工业上多用电解精炼法提纯镓。具体原理如下图所示:
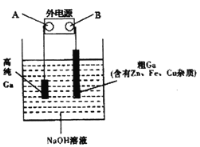
已知:金属的活动性Zn>Ga>Fe>Cu
①A为电源的_____极,电解精炼镓时产生阳极泥的主要成分是___________。
②电解过程中阳极产生的离子迁移到达阴极并在阴极放电析出高纯镓。请写出电解过程的阴极的电极反应_______________。
③电解过程中需控制合适的电压,若电压太高时阴极会产生H2导致电解效率下降。若外电路通过0.4mole-时,阴极得到7.0g的镓。则该电解装置的电解效率η=___________。(η=生成目标产物消耗的电子数÷转移的电子总数)。
查看答案和解析>>
科目: 来源: 题型:
【题目】现有化学反应A(g)+B(g)=AB(g)H(反应过程如曲线1所示),当反应体系中加入物质K后反应分两步进行(反应过程如曲线2所示):
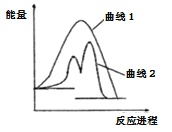
①A(g)+K(g)=AK(g)H1 ②AK(g)+B(g)=AB(g)+K(g)H2,根据图像分析,下列说法正确的是
A. 反应过程中AK(g)是催化剂 B. 加入催化剂会降低反应的H
C. H>0 D. lmolA(g)和1molB(g)的总能量高于1molAB(g)的能量
查看答案和解析>>
科目: 来源: 题型:
【题目】连二亚硫酸钠(Na2S2O4)俗称保险粉,是一种强还原剂。工业常用惰性电极电解亚硫酸氢钠的方法制备连二亚硫酸钠,原理装置如图所示,下列说法正确的是

A. N电极应该接电源的负极 B. 装置中所用离子交换膜为阴离子交换膜
C. H2SO4溶液浓度a%等于b% D. M电极的电极反应式为:2HSO3-+2e-+2H+=S2O42-+2H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】图A所示的转化关系中(具体反应条件略),a、b、c和d分别为四种短周期元素的常见单质,其余均为它们的化合物,i的溶液为常见三大强酸,a的一种同素异形体的晶胞如图B(正四面体立体网状结构)所示. 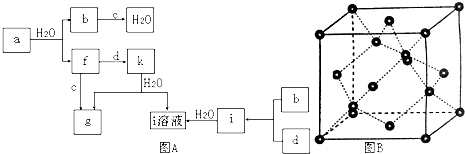
回答下列问题:
(1)图B对应的物质名称是 ,
(2)d中元素的原子核外电子排布式为 .
(3)图A中由二种元素组成的物质中,沸点最高的是 , 原因是 , 该物质的分子构型为 .
(4)图A中的双原子分子中,极性最大的分子是 .
(5)k的分子式为 , 中心原子的杂化轨道类型为 , 属于分子(填“极性”或“非极性”).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com