
科目: 来源: 题型:
【题目】甲烷、甲醇都是清洁能源。
(1)已知下列热化学方程式
①CO2(g)+3H2(g)=CH3OH(g) +H2O (g)△H= -49.0 kJ/mol
②CH4(g)+2O2(g)=2H2O(g) +CO2(g) △H= -802.3 kJ/mol
③2H2(g)+O2(g)=2H2O(l) △H=-571.6 kJ/mol
④H2O(g)=H2O(l) △H= -44.0 kJ-mol
则CH4(g)+1/2O2(g)=CH3OH(g) △H =____________。
(2)工业上合成甲醇的另一种方法是2H2(g)+CO(g) ![]() CH3OH(g) △H。
CH3OH(g) △H。
一定温度下在3个体积均为1.0 L的恒容密闭容器中发生上述反应,相关物理量见下表:
容器 | 温度/K | 物质的起始浓度/molL-1 | 物质的平衡浓度/mol.L-1 | ||
c(H2) | c(CO) | c(CH3OH) | c(CH3OH) | ||
I | 400 | 0.20 | 0.10 | 0 | 0.080 |
II | 400 | 0.40 | 0.20 | 0 | |
III | 500 | 0 | 0 | 0.10 | 0.025 |
①该反应的△H______0(填“>”或“<”)。
②达到平衡时,容器I中c(CH3OH)_____0.16mol/L(填“>” “<” 或“=”)。
③400 K 时该反应的平衡常数K=________。
(3)文献报道某课题组利用CO2催化缺化制甲烷的研究过程如下:
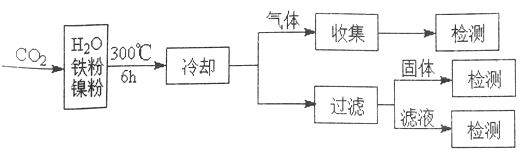
反应结束后,气体中检测到CH4和H2,滤液中检测到HCOOH,固体中检测到镍粉和Fe3O4。CH4、HCOOH、H2 的产量和镍粉用量的关系如下图所示(仪改变镍粉用量,其他条件不变)。研究人员根据实验结果得出结论:HCOOH 是CO2转化为CH4 的中间体,即:![]()
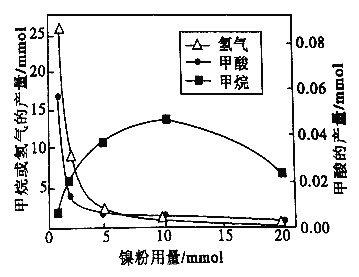
①写出产生H2的反应方程式_________。
②由图可知,镍粉是_______(填字母)。
a.反应I的催化剂 b.反应II 的催化剂
c.反应I和II的催化剂 d.不是催化剂
③当镍粉用量从1mmol增加到10mmol,反应速率的变化情况是______(填字母)。
a.反应1的速率增加,反应II的速率不变
b.反应I的速率不变,反应II的速率增加
c.反应I、II的速率均不变
d.反应I、II的速率均增加,且反应I的速率增加得快
e.反应I、II的速率均增加,且反应II 的速率增加得快
f.反应I的速率减小,反应II的速率增加
查看答案和解析>>
科目: 来源: 题型:
【题目】化学可以为人类制备新物质,还可以提供能源。
(1)乳酸能与金属铁反应制备一种药物,配平下列化学方程式:____。
![]()
这个反应中的还原产物的化学式是____
(2)已知氢气完全燃烧生成1 mol的液态水放出286 kJ热量,某宇宙飞船上使用的氢氧燃料电池每产生1 kw![]() h电能生成570 g液态水,该电池能量转化率为____
h电能生成570 g液态水,该电池能量转化率为____
查看答案和解析>>
科目: 来源: 题型:
【题目】稀土有工业“黄金”之称,我国稀土资源丰富。目前从氟碳铈矿(主要化学成分为CeFCO3)提取铈族稀土元素的冶炼处理工艺已经发展到十几种,其中一种提取铈的工艺流程如下:

已知:①焙烧后烧渣中含+4价的铈及+3价的其它稀土氟氧化物:
②Ce4+能与SO42-结合成CeSO4,Ce4+能被萃取剂[(HA)2]萃取。
请回答下列问题:
(1)CeFCO3中,Ce元素的化合价为_____。
(2)“酸浸I”过程中CeO2转化为Ce3+,且产生黄绿色气体,用稀硫酸和H2O2,替换HCl就不会造成环境污染。则稀硫酸.H2O2与CeO2反应的离子方程式为:__________。
(3)“沉淀”步骤中发生的反应为:Ce(BF4)3(s)+3KCl(aq)=3KBF4(s)+CeCl3(aq)。已知Ce(BF4)3、KBF4的Ksp分别为a、b,则该反应的平衡常数为______(用含a、b的代数式表示)。
(4)“浸出液”中含有少量Ce4+及其他稀土元素的离子,可以通过“萃取”与“反萃取寻探作进一步分离、富集各离子。“萃取”时Ce4+与萃取剂[(HA)2]存在的反应为:Ce4++n(HA)2![]() Ce(H2a-4A2a)+4H+。用D表示Ce4+分别在有机层中与水层中存在形式的浓度之比(D=
Ce(H2a-4A2a)+4H+。用D表示Ce4+分别在有机层中与水层中存在形式的浓度之比(D=![]() )其它条件不变,在浸出液中加入不同量的NaSO4以改变水层中的c(SO42-),D随浸出液中c(SO42-)增大而减小的原因是__________。
)其它条件不变,在浸出液中加入不同量的NaSO4以改变水层中的c(SO42-),D随浸出液中c(SO42-)增大而减小的原因是__________。
(5)“操作I”后,向溶液中加入NaOH溶液,调节溶液的pH可获得Ce(OH)3沉淀,当溶液中离子浓度小于1.0×10-6mol/L视为沉淀完全,常温下加入NaOH调节溶液的pH应大于_______[已知:Ce(OH)3的Ksp=8.0×10-21;1g2=-0.3]
(6)写出“氧化”步骤的化学方程式:_______________。
(7)CeO2是汽车尾气净化催化剂的关键成分,它能在还原气氛中供氧,在氧化气氛中耗氧在尾气消除过程中发生着CeO2![]() CeO2(1-x) +xO2↑(0≤x≤0.25)的循环。写出CeO2消除CO尾气的化学方程式:________________。
CeO2(1-x) +xO2↑(0≤x≤0.25)的循环。写出CeO2消除CO尾气的化学方程式:________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】通常情况下,晶体(“具有”或“不具有”)规则的几何外形和固定的熔点,非晶态物质则相反。常见的氯化钠、纯碱属于___(填“晶体”或“非晶态物质”,下同),而玻璃、石蜡属于___。
查看答案和解析>>
科目: 来源: 题型:
【题目】20℃时,在H2C2O4、NaOH混合溶液中,c(H2C2O4)+c(HC2O4-)+c(C2O42-)=0.100mol/L。含碳元素微粒的分布分数δ随溶液pH变化的关系如图所示。下列说法正确的是
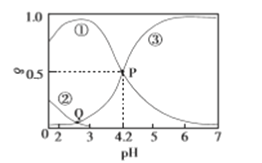
A. ①表示H2C2O4的分布曲线,③表示C2O42-的分布曲线
B. Q点对应的溶液中lgc(H+)<lgc(OH-)
C. 20℃时,H2C2O4的一级电离平衡常数Ka1=1×10-4.2
D. 0.100mol/L的NaHC2O4溶液中:c(OH-)=c(H+)- c(C2O42-)+c(H2C2O4)
查看答案和解析>>
科目: 来源: 题型:
【题目】短周期主族元素W、X、Y、Z、R原子序数依次增大。考古时利用W的一种同位素测定一些文物的年代,X是地壳中含量最多的元素,Y、Z的质子数分别是W、X的质子数的2倍。下列说法错误的是
A. Y单质可以与WX2发生置换反应
B. 工业上常用电解熔融的Y与R形成的化合物的方法制取Y
C. 原子半径:Y>Z>R;简单离子半径:Z>X>Y
D. 可以用澄清的石灰水鉴别WX2与ZX2
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学兴趣小组用下图装置进行制取乙酸乙酯的实验。
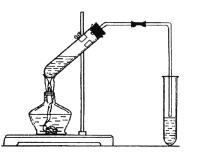
请回答下列问题:
(1)反应物中含有的官能团有____(填写名称)。
(2)实验室加入反应物和浓硫酸的先后顺序是____。
(3)浓硫酸在该反应中的作用是________。
(4)右边试管中的溶液是____,其作用是________。
(5)用同位素180示踪法确定反应原理(18O在CH3CH2OH中),写出能表示18O位置的化学方程式_______ ,反应类型是____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com