
科目: 来源: 题型:
【题目】
汽车尾气中的氮氧化物气体是导致雾霾的要原因之一。请回答下列有关尾气治理的问题:
(1)用化学方程式解释汽车尾气中含有NO的原因_______________________________。
(2)汽车排气管内安装的催化转化器,可使汽车尾气中的主要污染物NO、CO转化为无毒的大气循环物质。
已知:N2(g)+O2(g)=2NO(g) △H=+180.5kJmol-1
2C(s)+O2(g)=2CO(g) △H= -221.0kJmol-1
C(s)+O2(g)=CO2(g) △H= -393.5 kJmol-1
则分析反应2NO(g)+2CO(g)=N2(g)+2CO2(g)的△H= ___________kJmol-1。
(3)将0.20mol NO和0.10molCO充入一个容积恒定为1L的密闭容器中,在不同条件下反应过程中部分物质的浓度变化状况如图1所示。
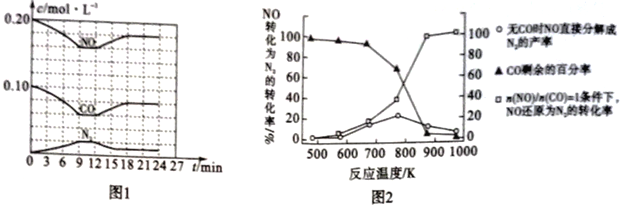
①计算反应在第9-12 min时的平衡常数K=____________。
②第12 min时改变的反应条件可能是_____________(任写一条)。
(4)某研究机构在实验室以Ag-ZSM-5为催化剂。测得单位时间内NO转化为N2的转化率随温度变化情况如图2所示。
①若不使用CO,发现当温度超过775 K时,NO的分解率降低,其可能的原因是________________。
②在n(NO)/n(CO) =1的条件下,为更好地除去NO,应控制的最佳温度应在____ K左右。
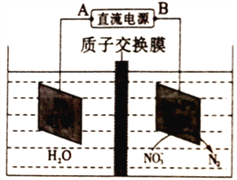
(5)氮氧化物进入水体可转化为NO3-,电化学降解法可用于治理水中NO3-的污染,原理如右图所示。则电源正极为______(选填“A”或“B”),阴极电极反应式为__________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上通常采用N2(g)和H2(g)崔华成NH3(g):N2(g)+3H2(g)2NH3(g)△H=﹣92.4kJmol﹣1
(1)在一定温度下,若将10amolN2和30amolH2放入2L的密闭容器中,充分反应后测得平衡时N2的转化率为60%,则该反应的平衡常数为(用含a的代数式表示).若此时再向该容器中投入10amolN2、20amolH2和20amolNH3 , 判断平衡移动的方向是(填“正向移动”“逆向移动”或“不移动”).
(2)若反应起始时N2、H2、NH3的浓度分别为0.1mol/L、0.3mol/L、0.1mol/L.则NH3达到平衡时浓度的范围为;若平衡时N2、H2、NH3的浓度分别为0.1mol/L、0.3mol/L、0.1mol/L,则NH3起始时浓度的范围为 .
(3)一定条件下,在容积相同的三个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如表:
容器 | 甲 | 乙 | 丙 | |
反应物投入量 | 1molN2、3molH2 | 2molNH3 | 4molNH3 | |
平衡时数据 | 反应能量变化的绝对值(kJ) | Q1 | Q2 | Q3 |
反应物转化率 | a1 | a2 | a3 | |
体系压强(Pa) | p1 | P2 | P3 | |
则Q1+Q2=kJ;a1+a2l(填“<”“>”或“=”下同):2p2p3
(4)如图:A是恒容的密闭容器,B是一个体积可变的充气气囊.保持恒温,关闭K2 , 将1molN2和3molH2通过K3充入B中,将2molN2和6molH2通过K1充入A中;起始时A、B的体积相同均为1L,达到平衡时,V(B)=0.9L;然后打开K2 , 一段时间又达到平衡时,B的体积为L(连通管中气体体积不计).
查看答案和解析>>
科目: 来源: 题型:
【题目】化学反应中的能量变化,通常主要表现为热量的变化.某实验小组用0.50mol/L NaOH溶液和0.50mol/L硫酸溶液进行中和热的测定.测定中和热的实验装置如图所示:
(1)该图中有两处仪器未画出,它们是、 .
(2)写出稀硫酸和稀氢氧化钠溶液反应表示中和热的热化学方程式为(中和热数值为57.3kJ/mol) .
(3)取55mLNaOH溶液和25mL硫酸溶液进行实验,实验数据如表.
实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | ||
H2SO4 | NaOH | 平均值 | ||
① | 26.2 | 26.0 | 26.1 | 30.1 |
② | 27.0 | 27.4 | 27.2 | 33.3 |
③ | 25.9 | 25.9 | 25.9 | 29.8 |
④ | 26.4 | 26.2 | 26.3 | 30.4 |
近似认为0.50mol/L NaOH溶液和0.50mol/L硫酸溶液的密度都是1g/cm2 , 中和后生成溶液的比热容c=4.08J/(g℃).则中和热△H=(取小数点后一位).
(4)有关中和热测定实验,下列说法错误的是
a.用温度计测定NaOH溶液起始温度后马上直接测定H2SO4溶液的温度会导致中和热数值比57.3低
b.温度计的冲洗液应倒入小烧杯参与反应
c.混合硫酸和氢氧化钠溶液时应分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.若装置完全相同,操作均没失误,取110mLNaOH溶液和50mL硫酸溶液进行实验,误差比55mLNaOH溶液和25mL硫酸溶液进行实验误差小.
查看答案和解析>>
科目: 来源: 题型:
【题目】下面是某工厂利用电镀污泥(主要含有Fe2O3、CuO、Cr2O3及部分难溶杂质)回收铜和铬的流程:

请回答下列问题:
已知部分物质沉淀的pH及CaSO4的溶解度曲线如下:
(1)在浸出过程中除生成Cr2(SO4)3外,主要还生成__________________。
(2)流程中“第一次调节“pH”是为了除去Fe3+,所加试剂X可以是_______(任写一种)。当离子浓度小于或等于1×10-5时可认为沉淀完全,若要使Fe3+完全沉淀,则应调节溶液pH≥__________已知(Ksp[Fe(OH)3]=8×10-38,1g2=0.3)
(3)写出还原步骤中生成Cu2O沉淀反应的离子方程式______________________________。此步骤中若NaHSO3过量。除了浪费试剂外,还可能出现的问题是________________________。
(4)流程中“第二次调节pH”应小于9,因为Cr(OH)3是两性氢氧化物,试写出Cr(OH)3与NaOH溶液反应的离子方程式___________________________。
(5)Cr(OH)3受热分解为Cr2O3,再用铝热法可以得到金属Cr。写出其中用铝热法冶炼得到金属Cr的化学方程式________________________________。
(6)化学需氧量(COD)可量度水体受有机物污染的程度,以K2Cr2O7作强氧化剂处理水样时所消耗的K2Cr2O7的量换算成相当于O2的含量(以mg·L-1计)来计量。
①处理时,水样应先酸化,最好选用__________(选填“稀硝酸”、“稀硫酸”或“稀盐酸”)酸化。
②在该条件下,Cr2O72-最终转化为Cr3+、取水样100mL,处理该水样时消耗了10mL0.025 mol·L-1 K2Cr2O7溶液。则该水样的COD为__________ mg·L-1。
查看答案和解析>>
科目: 来源: 题型:
【题目】化学反应速率是化学反应原理的重要组成部分.请回答下列问题:
(1)已知一定条件下发生反应:2SO2(g)+O2(g)2SO3(g)△H<0,在反应过程中,正反应速率的变化如图所示,请根据速率的变化回答采取的措施(改变的条件).
(2)探究反应条件对0.10mol/L,Na2S2O3溶液与稀H2SO4反应速率的影响.其设计与测定结果如表:
编号 | 反应温度/℃ | Na2S2O3浓液/mL | 甲 | 0.1mol/LH2SO4溶液/mL | 乙 |
① | 25℃ | 10.0 | 0 | 10.0 | |
② | 25℃ | 5.0 | a | 10.0 | |
③ | 45℃ | 10.0 | 0 | 10.0 |
上述实验①③是探究对化学反应速率的影响;若上述实验①②是探究浓度对化学反应速率的影响,则表格中“甲”为 , a为;乙是实验需要测量的物理量,则表格中“乙”为 .
(3)已知2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+8H2O+10CO2↑,在开始一段时间内,反应速率较小,溶液褪色不明显;但不久突然褪色,反应速率明显增大.
①针对上述现象,某同学认为该反应放热,导致溶液温度上升,反应速率增大.从影响化学反应速率的因素看,你猜想还可能是的影响.
②若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液外,可以在反应一开始时加入(填字母序号).
A.硫酸钾B.氯化锰c.硫酸锰D.水.
查看答案和解析>>
科目: 来源: 题型:
【题目】“封管实验”具有简易、方便、节约、绿色等优点,下列关于三个“封管实验”(夹持装置未画出)的说法正确的是( )

A. 加热时,①中上部汇集了NH4Cl固体
B. 加热时,②中溶液变红,冷却后又都变为无色
C. 加热时,③中溶液红色褪去,冷却后溶液变红,体现SO2的漂白性
D. 三个“封管实验”中所发生的化学反应都是可逆反应
查看答案和解析>>
科目: 来源: 题型:
【题目】已知NO2和N2O4可以相互转化:2NO2(g)N2O4(g)(正反应为放热反应).现将一定量NO2和N2O4的混合气体通入一体积为2L的恒温密闭容器中,反应物物质的量随时间变化关系如图所示,则下列说法错误的是( )
A.前10min内用NO2表示的化学反应速率v(NO2)=0.02mol/(Lmin)
B.反应进行至25min时,曲线发生变化的原因可以是向容器中添加NO2(g)
C.若要达到与最后相同的化学平衡状态,在25min时还可以采取的措施是添加N2O4(g)
D.a、b、c、d四个点中,表示化学反应处于平衡状态的点成是b和d
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、C、D是原子序数依次增大的四种短周期元素,m、n、p、q、s是由这些元素中的两种或三种元素组成的化合物,r是由元素C形成的单质,上述物质的转化关系如图所示。常温下0.01 mol·L-1s溶液的pH为12。下列说法正确的是

A. 原子半径的大小B<C<D
B. 化合物n与s中均既含有离子键,又含有共价键
C. 1L0.1mol·L-1的q溶液中阴离子总数等于0.1NA
D. 1mol n与足量的p完全反应可生成11.2L的r
查看答案和解析>>
科目: 来源: 题型:
【题目】短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示。下列说法正确的是( )

A. 元素X与元素Z的最高正化合价之和的数值等于8
B. 原子半径的大小顺序为:r(X)>r(Y)>r(Z)>r(W)>r(Q)
C. 离子Y2-和Z3+的核外电子数和电子层数都不相同
D. 元素W的最高价氧化物对应的水化物的酸性比Q的强
查看答案和解析>>
科目: 来源: 题型:
【题目】已知常温下氢硫酸H2S的电离平衡常数为K1=1.3×10-7,K2=7.1×10-15。下列说法正确的是
A. 在NaHS和Na2S的溶液中都存在c(Na+)+c(H+)=c(HS-)+c(S2-)+c(OH-)
B. 相同温度下,同浓度的NaHS与Na2S溶液的pH比较:前者大于后者
C. 在0.1mol·L-1的NaHS溶液中,存在c(HS-)+c(S2-)=0.1 mol·L-1
D. 向NaHS溶液中加入少量NaOH溶液时,溶液中![]() 、
、![]() 的值均增大
的值均增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com