
科目: 来源: 题型:
【题目】
(1)I.已知:Na2S2O3 + H2 SO4=Na2SO4 + SO2↑+S↓+H2O,某同学探究影响硫代硫酸钠与稀硫酸反应速率的因素时,设计了如下系列实验:
实验序号 | 反应温度/℃ | Na2S2O3溶液 | 稀H2SO4 | H2O | ||
V/mL | c/(mol/L) | V/mL | c/(mol/L) | V/mL | ||
① | 20 | 10.0 | 0.10 | 10.0 | 0.50 | 0 |
② | 40 | V1 | 0.10 | V2 | 0.50 | V3 |
③ | 20 | V4 | 0.10 | 4.0 | 0.50 | V5 |
①该实验①、②可探究温度对反应速率的影响,因此V1= , V2 = , V3=;
(2)②若V4=10.0,V5=6.0,则实验①、③可探究 对反应速率的影响。
(3)Ⅱ.利用反应:I2+2Na2S2O3=Na2S4O6+2NaI可定量测定硫代硫酸钠(Mr=158)的纯度,现在称取wg硫代硫酸钠固体样品,配成250 mL的溶液,取25.00 mL置于锥形瓶中,加入指示剂,用a mol/L的碘水滴定,消耗碘水b mL,则:
①滴定应选择的指示剂是 , 滴定终点的现象为。
②对于该滴定实验的有关操作或误差分析正确的是。
A.滴定前,要用对应装入的溶液润洗滴定管和锥形瓶
B.滴定过程中,标准液滴到锥形瓶外,会使所测得的结果偏大
C.滴定开始时滴定管尖嘴有气泡,滴定结束后气泡消失,测得纯度将偏小
D.滴定前仰视读数而滴定结束时俯视读数,则所测得的纯度将会偏小
③样品中硫代硫酸钠纯度的表达式为。
查看答案和解析>>
科目: 来源: 题型:
【题目】
(1)在一个1L的密闭容器中,加入2molA和1 mol B,发生下列反应:
2A(g) + B(g) ![]() 3C (g) + D(s),达到平衡时C的浓度为1.2 mol/L。
3C (g) + D(s),达到平衡时C的浓度为1.2 mol/L。
①维持容器的温度不变,若缩小容器的体积,则平衡向(填“正反应方向”、“逆反应方向”或“不”)移动。
②维持容器的体积和温度不变,按下列四种配比作为起始物质,达到平衡后,C的浓度仍是1.2 mol/L的是(填序号);
A.4 mol A+2 mol B
C.2 mol A+1 mol B+3 mol C
B.3 mol C+2molD
③达平衡后若升高温度,B的浓度增加,则正反应的△H(填“>”、“<”或“=”)0。
(2)下图1 mol NO2和1 mol CO反应生成CO2和NO中,CO和NO的浓度随时间变化的示意图。回答下列问题:
①从反应开始到t1时刻,用NO2浓度变化表示平均反应速率v(NO2)=。
②此温度下该反应的平衡常数K=。
查看答案和解析>>
科目: 来源: 题型:
【题目】下图是一个化学过程的示意图。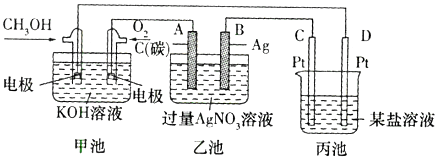
(1)图中丙池是装置(填“电解池”或“原电池”),甲池中K+移向极(填“CH3OH”或“O2”)。
(2)写出通入CH3OH的电极的电极反应式:。
(3)向乙池两电极附近滴加适量紫色石蕊试液,附近变红的电极为极(填“A”或“B")。
(4)乙池中总反应的离子方程式。
(5)当乙池中B(Ag)极的质量增加5.40 g时,乙池的pH是(若此时乙池中溶液的体积为500 mL);通过导线的电量是(结果保留3位有效数字,已知:NA =6.02×1023 , 电子的电量为1.60 ×10-19);此时丙池某电极析出1.60 g某金属,则丙中的某盐溶液可能是
A.MgSO4 B.CuSO4
C.NaCl D.AgNO3
查看答案和解析>>
科目: 来源: 题型:
【题目】关于下列各装置图的叙述中,正确的是
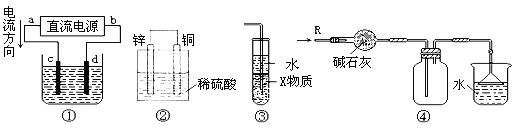
A. 若采用装置①铝件镀银,则c极为铝件,d极为纯银,电解质溶液为AgNO3溶液
B. 装置②是原电池,能将化学能转化为电能,SO42-移向锌电极
C. 装置③中X若为四氯化碳,用于吸收氨气或氯化氢,会引起倒吸
D. 装置④可用于收集氨气,并吸收多余的氨气
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学研究性学习小组针对原电池形成条件,设计了实验方案,进行如下探究。
(1)请填写有关实验现象并得出相关结论。
编号 | 实验装置 | 实验现象 |
1 |
| 锌棒逐渐溶解,表面有气体生成;铜棒表面无现象 |
2 |
| 两锌棒逐渐溶解,表面均有气体生成;电流计指针不偏转 |
3 |
| 铜棒表面的现象是______________________,电流计指针___________________ |
①通过实验2和3,可得出原电池的形成条件是______________________________。
②通过实验1和3,可得出原电池的形成条件是______________________________。
③若将3装置中硫酸换成乙醇,电流计指针将不发生偏转,从而可得出原电池形成条件是___________________。
(2)分别写出实验3中Zn棒和Cu棒上发生的电极反应式:
Zn棒:______________________________。
Cu棒:______________________________。
(3)实验3的电流是从________棒流出(填“Zn”或“Cu”),反应过程中若有0.4mol电子发生了转移,则Zn电极质量减轻___________g。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法错误的是( )
A.硅太阳能电池、计算机芯片、光导纤维都用到硅单质
B.水晶镜片、石英钟表、玛瑙手镯含有SiO2
C.水泥路桥、门窗玻璃、砖瓦、陶瓷餐具所用材料为硅酸盐
D.熔融烧碱时不能使用普通玻璃坩埚、石英坩埚和陶瓷坩埚
查看答案和解析>>
科目: 来源: 题型:
【题目】某温度下,气体X和Y在体积为2L的密闭容器中反应,生成气体Z。经测定各物质的物质的量随时间变化如下图所示,经10s达到化学平衡状态,请回答下列问题。
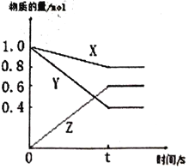
(1)写出该反应的化学反应方程式____________________________________。
(2)0-10s内,Y的平均反应速率为______________________。
(3)达到平衡时,X的转化率为______________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】有机物A含有C、H、O三种元素,6.2g完全燃烧后将产物经过浓H2SO4,浓硫酸质量增重5.4g;剩余气体再通过碱石灰被完全吸收,质量增加8.8g。经测定A的相对分子质量为62。(已知两个羟基连在同一个碳上不稳定会自动失去一个水)
(1)试通过计算推断该有机物的分子式_________。
(2)若0.1mol该有机物恰好与4.6g金属钠完全反应,则该有机物的结构简式为________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于右图所示转化关系(X代表卤素)的说法错误的是:
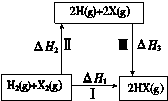
A.2H(g) +2X(g) = 2HX(g) ΔH3<0
B.ΔH1 = ΔH2 + ΔH3
C.Cl、Br、I的非金属性依次减弱,所以途径Ⅱ吸收的热量按Cl、Br、I的顺序依次增多
D.途径Ⅰ生成HCl放出的热量比生成HBr的多,说明HCl比HBr稳定
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com