
科目: 来源: 题型:
【题目】某恒定温度下,在一个2L的密闭容器中充入A气体、B气体,测得其浓度为2mol/L和1mol·L-1;且发生如下反应:3A(g)+2B(g)![]() 4C(?)+2D(?)已知“?”代表C、D状态未确定;反应一段时间后达到平衡,测得生成1.6molC,且反应前后压强比为5:4,则下列说法中正确的是( )
4C(?)+2D(?)已知“?”代表C、D状态未确定;反应一段时间后达到平衡,测得生成1.6molC,且反应前后压强比为5:4,则下列说法中正确的是( )
①该反应的化学平衡表达式为:K= 
②此时B的转化率为35%
③增大该体系压强,平衡向右移动,但化学平衡常数不变.
④增加C的量,A、B转化率不变
A.①② B.②③ C.①④ D.③④
查看答案和解析>>
科目: 来源: 题型:
【题目】在2L密闭容器内,加入0.100molCO气体和0.080molCuO固体,800℃时发生如下反应:2CuO(s)+CO(g)![]() Cu2O(s)+CO2(g),n(CuO)随时间的变化如表:
Cu2O(s)+CO2(g),n(CuO)随时间的变化如表:
时间(min) | 0 | 1 | 2 | 3 | 4 | 5 |
n(CuO)(mol) | 0.080 | 0.060 | 0.040 | 0.020 | 0.020 | 0.020 |
(1)用CO表示前2min内的化学反应速率=
(2)计算此反应在800C时的化学平衡常数k=
(3)若向平衡后的体系中加入CO和CO2各0.05mol,则此时V(正) V(逆)
(4)用来还原CuO的CO可以用C和水蒸气反应制得。
已知:![]() H=-393.5kJ/mol
H=-393.5kJ/mol
![]() H=-566kJ/mol
H=-566kJ/mol
![]() H=-571.6kJ/mol
H=-571.6kJ/mol
则C(s)+H2O(g)![]() CO(g)+H2(g) H= 。
CO(g)+H2(g) H= 。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法中正确的是( )
A. Na2O2晶体中的阳离子与阴离子个数比为1:1
B. 石墨晶体中C原子数与C—C共价键数比为1:3
C. 3HO与2HO分子中的质子个数比为1:1
D. 冰晶体中H2O分子个数与氢键数目比为1:4
查看答案和解析>>
科目: 来源: 题型:
【题目】已知某些金属离子形成相应氢氧化物时的相关PH值见下表:
难溶物质 | Cu(OH)2 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
0.1mol/L的金属离子 开始沉淀时PH值 | 4.8 | 1.9 | 3.4 | 9.1 |
完全沉淀(C≦10-5)时PH值 | 6.7 | 3.2 | 4.7 | 11.2 |
(1)某酸性CuCl2溶液中含有少量的FeCl3,为得到较纯的CuCl2·2H2O晶体,可加入______________,调节溶液PH 值至pH=4,使溶液中的Fe3+转化为Fe(OH)3沉淀。过滤后,将所得滤液经过(填简要实验操作) __________、_________,可得CuCl2·2H2O晶体。
(2)若在空气中直接加热CuCl2·2H2O晶体得不到纯的无水CuCl2,其原因是______________________________________(用化学方程式表示)。则由CuCl2·2H2O晶体得到纯的无水CuCl2的合理方法是__________________________。(填写简要的实验步骤或操作)
(3)某学习小组用一定浓度的NaOH溶液作为上述某些金属离子分离时的PH控制试剂,为此需准确滴定其浓度,现用已知浓度0.200 mol/L的标准盐酸进行滴定。请回答:
①取0.200 mol/L的标准盐酸来滴定时,以下操作引起NaOH浓度偏小的是______
A.开始滴定时滴定管尖嘴处留有气泡,滴定后气泡消失
B.指示剂变色即停止滴定,溶液又很快(半分钟内)恢复原色
C.滴定开始时仰视读数,滴定终点时俯视,其余操作正常
D.取用碱液前锥形瓶用蒸馏水洗涤后未风干,其余操作正常
②小组中有同学用另一方法计算出了所用NaOH溶液浓度:取100.00 ml 待测NaOH溶液,向内加入0.200 mol/L的标准盐酸50.00 ml,充分反应后,向所得溶液中加入足量铁粉,收集到标准状况下的气体67.2 ml,则该同学所测得原NaOH溶液在常温下的PH值为____________ (结果保留1位小数,已知lg2=0.3)
查看答案和解析>>
科目: 来源: 题型:
【题目】已知氨气在生活、生产、科研中有极广泛用途。
(1)已知反应Ⅰ:2NH3(g)+CO2(g)═NH2CO2NH4(s)△H=﹣159.5kJ/mol
反应Ⅱ:NH2CO2NH4(s)═CO(NH2)2 (s)+H2O(g)△H= + 116.5kJ/mol
反应Ⅲ:H2O(l)═H2O(g)△H= + 44.0kJ/mol
工业上以CO2、NH3为原料合成尿素和液态水的热化学方程式为___________________,该反应在_________条件下可以自发进行(填“高温”、“低温”或“任何温度下”);
(2)查阅资料可知:常温下,K稳[Ag(NH3)2+]=1.00×107,Ksp[AgCl]=2.50×10﹣10.
①银氨溶液中存在平衡:Ag+(aq)+2NH3(aq)![]() Ag(NH3)2+ (aq),该反应平衡常数的表达式为K稳=_______________;
Ag(NH3)2+ (aq),该反应平衡常数的表达式为K稳=_______________;
②计算得到可逆反应AgCl (s)+2NH3(aq)![]() Ag(NH3)2+ (aq)+Cl﹣(aq)的化学平衡常数K=_________________________;在1L浓度为1mol/L氨水中最多可以溶解AgCl为_______mol(保留2位有效数字)。
Ag(NH3)2+ (aq)+Cl﹣(aq)的化学平衡常数K=_________________________;在1L浓度为1mol/L氨水中最多可以溶解AgCl为_______mol(保留2位有效数字)。
查看答案和解析>>
科目: 来源: 题型:
【题目】卤族元素是非常重要的非金属元素,其单质和化合物有广泛用途,化学性质也非常丰富。
(1)基态氯原子的价电子排布式为__________________,其核外电子占据的最高能层的符号是_________。
(2)在不太稀的溶液中,氢氟酸是以二分子缔合(HF)2形式存在的。使氢氟酸分子缔合的作用力是___________。
(3)ClO2—的立体结构为_______形,中心氯原子的杂化轨道类型为_________,写出ClO2—一个等电子体的化学式 ______。
(4)下列分子中只存在s-p![]() 键的是_____________。
键的是_____________。
A. H2 B.F2 C.HCl D.HClO
(5)CsICl2不稳定,受热时可能按下列两种方式分解,已知生成物晶格能越大反应越易发生,则CsICl2按下列______方式分解更合理。
A.CsICl2=CsI+Cl2 B. CsICl2=CsCl+ICl
(6)由F、K、Mg三种元素形成的某离子晶体的晶胞结构如下图所示,晶胞边长为a nm(1nm=10—9m)。
①该晶体的化学式为___________________。
②该晶体的密度为____________gcm—3。(结果保留1位小数)

查看答案和解析>>
科目: 来源: 题型:
【题目】金属氢氧化物在酸中溶解度不同,因此可以利用这一性质,控制溶液的pH,达到分离金属离子的目的。难溶金属的氢氧化物在不同pH下的溶解度(S/mol/L)如图所示。

(1)当pH=3时,溶液中铜元素的主要存在形式是__________。
(2)若要除去CuCl2溶液中的少量Fe3+,应该控制溶液的pH值为______ (填序号)。
A.<1 B.4左右 C.8>PH>6 D.>9
(3)在Ni(NO3)2溶液中含有少量的Co2+杂质,________(填“能”或“不能”)通过调节溶液pH的方法来除去,理由是_____________________________________________。
(4)已知一些难溶电解质的溶度积常数如右下表:
物质 | FeS | MnS | PbS | HgS | ZnS | CuS |
Ksp | 6.3×10-18 | 2.5×10-13 | 3.4×10-28 | 6.4×10-33 | 1.6×10-24 | 1.3×10-35 |
为除去某工业废水中含有的Cu2+、Pb2+、Hg2+杂质,最适宜向此工业废水中加入过量的___________(填序号)。
A.NaOH B.FeS C.Na2S D.NH4Cl
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上用CO生产燃料甲醇。一定温度和容积条件下发生反应:CO(g)+2H2(g)![]() CH3OH(g)。图1表示反应中的能量变化;图2表示一定温度下,在体积为1L的密闭容器中加入2mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化。
CH3OH(g)。图1表示反应中的能量变化;图2表示一定温度下,在体积为1L的密闭容器中加入2mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化。
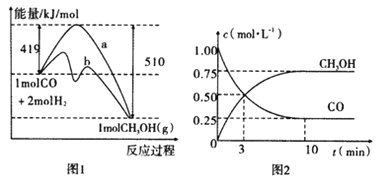
请回答下列问题:
(1)在“图1”中,曲线_________(填“a”或“b”)表示使用了催化剂;没有使用催化剂时,在该温度和压强条件下反应CO(g)+2H2(g)![]() CH3OH(g)的△H=_____________。
CH3OH(g)的△H=_____________。
(2)下列说法正确的是__________。
A.起始充入的CO的物质的量为1mol
B.增加CO的浓度,H2的转化率会增大
C.容器中压强恒定时,反应达到平衡状态
(3)从反应开始到建立平衡,v(CO)=____________;达到平衡时,c(H2)=_________,该温度下CO(g)+2H2(g) ![]() CH3OH(g)的化学平衡常数为______________。达到平衡后若保持其它条件不变,将容器体积压缩为0.5L,则平衡___________移动 (填“正向”、“逆向”或“不”)(4)已知CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g);ΔH=-193kJ/mol。又知H2O(l)= H2O(g)ΔH=+44 kJ/mol,请写出32g的CH3OH(g)完全燃烧生成液态水的热化学方程式___________________________________________________。
CH3OH(g)的化学平衡常数为______________。达到平衡后若保持其它条件不变,将容器体积压缩为0.5L,则平衡___________移动 (填“正向”、“逆向”或“不”)(4)已知CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g);ΔH=-193kJ/mol。又知H2O(l)= H2O(g)ΔH=+44 kJ/mol,请写出32g的CH3OH(g)完全燃烧生成液态水的热化学方程式___________________________________________________。
(5)已知白磷和PCl3的分子结构如图所示,现提供以下化学键的键能(kJ·mol-1):P—P:198,Cl—Cl :243,P—Cl:331。
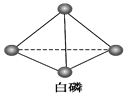
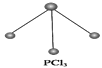
则反应P4(白磷,s)+6Cl2(g)![]() 4PCl3(s)的反应热ΔH=____________________。
4PCl3(s)的反应热ΔH=____________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】在100mL 稀HNO3和稀H2SO4组成的混合溶液中,两种酸的物质的量浓度之和为0.4mol/L.向该溶液中加入足量的铜粉后加热,充分反应后,所得溶液中Cu2+的物质的量浓度最大值为(反应前后溶液体积变化忽略不计)
A. 0.15mol/L B. 0.24mol/L C. 0.30mol/L D. 0.36mol/L
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法中正确的是( )
A. 金刚石晶体中的最小碳环由6个碳原子构成
B. Na2O2晶体中阴离子与阳离子数目之比为1:1
C. 1 mol SiO2晶体中含2 mol Si—O键
D. 金刚石化学性质稳定,在高温下也不会和O2反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com