
科目: 来源: 题型:
【题目】在无色透明溶液中,下列各组中的离子一定能大量共存的是( )
A.K+、H+、SO42-、MnO4-B.Na+、Ca2+、Cl-、NO3-
C.Ag+、H+、Cl-、CH3COO-D.Ba2+、K+、OH-、SO42-
查看答案和解析>>
科目: 来源: 题型:
【题目】“雾霾”成为人们越来越关心的环境问题。雾霾中含有二氧化硫、氮氧化物和可吸入颗粒物等污染性物质。请回答下列问题:
(1)汽车尾气是雾霾形成的原因之一。尾气治理可用汽油中挥发出来的烃类物质(CxHy)催化还原尾气中的NO气体,该过程的化学方程式为___________________。
(2)冬季燃煤供暖产生的废气也是雾霾的主要来源之一。经研究发现将煤炭在O2/CO2的气氛下燃烧,能够降低燃煤时NO的排放,主要反应为:
2NO(g)+2CO(g)![]() N2(g)+2CO2(g) ΔH
N2(g)+2CO2(g) ΔH
已知:①N2(g)+O2(g)![]() 2NO(g) ΔH1=+180.5 kJ·mol-1
2NO(g) ΔH1=+180.5 kJ·mol-1
②2CO(g)![]() 2C(s)+O2(g) ΔH2=+221 kJ·mol-1
2C(s)+O2(g) ΔH2=+221 kJ·mol-1
③C(s)+O2(g)![]() CO2(g) ΔH3=-393.5 kJ·mol-1
CO2(g) ΔH3=-393.5 kJ·mol-1
则ΔH=_____________。
(3)某研究小组用NaOH溶液吸收尾气中的二氧化硫,将得到的Na2SO3溶液进行电解,其中阴阳膜组合电解装置如图一所示,电极材料为石墨。
①a表示_____离子交换膜(填“阴”或“阳”)。A~E分别代表生产中的原料或产品,其中C为硫酸,则A表示_________,E表示___________。
②阳极的电极反应式为___________________________。
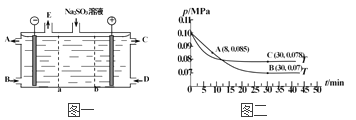
(4)SO2经过净化后与空气混合进行催化氧化可制取硫酸,其中SO2发生催化氧化的反应为:2SO2(g)+O2(g)![]() 2SO3(g)。若在T1℃、0.1 MPa条件下,往一密闭容器通入SO2和O2[其中n(SO2) ∶n(O2)=2∶1],测得容器内总压强与反应时间如图二所示。
2SO3(g)。若在T1℃、0.1 MPa条件下,往一密闭容器通入SO2和O2[其中n(SO2) ∶n(O2)=2∶1],测得容器内总压强与反应时间如图二所示。
①图中A点时,SO2的转化率为____________。
②在其他条件不变的情况下,测得T2℃时压强的变化曲线如图所示,则C点的正反应速率vc(正)与A点的逆反应速率vA(逆)的大小关系为vc(正)______vA(逆)(填“>”、“<”或“=”)。
③图中B点的压强平衡常数Kp=_______________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,用0.1000mol/L NaOH溶液滴定 20.00mL 0.1000 mol/L
CH3COOH溶液滴定曲线如右图。下列说法正确的是

A. 点①所示溶液中:c(CH3COO-)+ c(OH-) =c(CH3COOH)+ c(H+)
B. 点②所示溶液中:c(Na+) =c(CH3COOH)+ c(CH3COO-)
C. 点③所示溶液中:c(Na+)> c(OH-)> c(CH3COO-)> c(H+)
D. 滴定过程中可能出现:c(CH3COOH)> c(CH3COO-)> c(H+)> c(Na+)> c(OH-)
查看答案和解析>>
科目: 来源: 题型:
【题目】材料是人类赖以生存与发展的重要物质基础。
(1)普通玻璃的主要成分是Na2SiO3、CaSiO3和___(填化学式)。用于汽车或火车车窗的玻璃是___玻璃。
(2)在复合材料由两部分组成,,一部分作___,另一部分作______,如_____就是一种复合材料。
(3)硅酸盐水泥的主要成分是_______, 为调节水泥的硬化速度,常在水泥中加入___。
(4)工业上制水泥和玻璃需用到的共同原料是______,制水泥和陶瓷需用到的共同原料是___。
查看答案和解析>>
科目: 来源: 题型:
【题目】磁性纳米四氧化三铁在催化剂、DNA检测、疾病的诊断和治疗等领域应用广泛,其制备方法有多种,“共沉淀法”制备纳米Fe3O4的流程如下:

(1)Ⅱ中的反应温度需控制在50℃~60℃之间,实验室控制该温度的最佳方法是___________。
(2)Ⅱ中生成Fe3O4的离子方程式是_____________________________________。
(3)操作Ⅲ包含的方法有_______________。
(4)检验纳米Fe3O4中含有+2价铁元素的方法是_________________________________。
(5)某同学依据上述“共沉淀法”的思路在实验室模拟制备纳米Fe3O4:
① 制备时该同学选择n(Fe3+)∶n(Fe2+)小于2∶1,原因是_______________________。
②经过多次实验发现,当混合溶液中n(Fe3+)∶n(Fe2+)=1∶1时,容易得到理想的纳米Fe3O4。该实验室无FeCl2溶液,现用5mLFeCl3溶液制备Fe3O4,配制n(Fe3+)∶n(Fe2+)=1∶1混合溶液的方法是_____________________(其它试剂和仪器自选)。
查看答案和解析>>
科目: 来源: 题型:
【题目】一定条件下,利用如图所示装置可实现有机物的储氢,下列有关说法正确的是( )
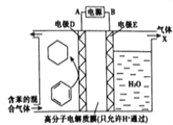
A. 气体X是氢气,电极E是阴极
B. H+由左室进入右室,发生还原反应
C. 该储氢过程就是C6H6与氢气反应过程
D. 电极D的电极反应式为C6H6+6H++6e-=C6H12
查看答案和解析>>
科目: 来源: 题型:
【题目】恒温时,将2molA和2molB气体投入固定容积为2L密闭容器中发生反应:2A(g)+ B(g)![]() xC(g)+D(s),10s时,测得A的物质的量为1.7mol,C的反应速率为0.0225mol·L-1·s-1;40s时反应恰好处于平衡状态,此时B的转化率为20%。请填写下列空白:
xC(g)+D(s),10s时,测得A的物质的量为1.7mol,C的反应速率为0.0225mol·L-1·s-1;40s时反应恰好处于平衡状态,此时B的转化率为20%。请填写下列空白:
(1)x = _________________
(2)从反应开始到10s,B的平均反应速率为______________
(3)平衡时容器中B的体积分数为___________________
(4)该温度下此反应的平衡常数表达式为_______________
(5)下列各项能表示该反应达到平衡状态是_____________
A.消耗A的物质的量与生成D的物质的量之比为2∶1
B.容器中A、B的物质的量 n(A)∶n(B) = 2∶1
C.气体的平均相对分子质量不再变化
D.压强不再变化
E.气体的物质的量不再变化
查看答案和解析>>
科目: 来源: 题型:
【题目】如图是部分短周期元素原子半径与原子序数的关系图,下列说法正确的是( )
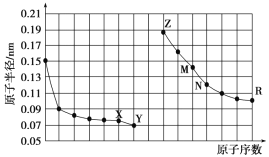
A. M、N的氧化物都能与Z、R的最高价氧化物对应水化物反应
B. Y的单质能从含R简单离子的水溶液中置换出R单质
C. X、M两种元素组成的化合物熔点很高
D. 简单离子的半径:R>M>X
查看答案和解析>>
科目: 来源: 题型:
【题目】下列应用或事实与胶体的性质没有关系的是( )
A.用明矾净化饮用水
B.在氯化铁溶液中滴加NaOH溶液出现红褐色沉淀
C.清晨的阳光穿过茂密的树林产生美丽的光束
D.用石膏或盐卤点制豆腐
查看答案和解析>>
科目: 来源: 题型:
【题目】下列用系统命名法命名的有机物名称正确的是( )
A. 2 -甲基--4--乙基戊烷 B. 2, 3 --二甲基--1--戊烯
C. 3, 4, 4--三甲基己烷 D. 2, 2--二甲基-2-丁烯
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com