
科目: 来源: 题型:
【题目】下图是部分短周期主族元素原子半径与原子序数的关系图。下列说法正确的是
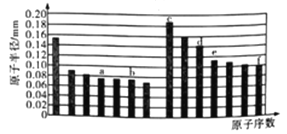
A. a的最高价氧化物与e的最高价氧化物结构相似,都为酸性氧化物且不能与任何酸反应
B. b、c、d、f四种元素的简单离子半径比较: f>b>c>d
C. c、d分别与f组成的化合物均为离子化合物
D. a、f的氧化物对成的水化物酸性及气态氢化物的稳定性f>a
查看答案和解析>>
科目: 来源: 题型:
【题目】如下图所示是中学化学中常用于混合物分离和提纯的装置:
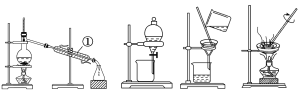
A B C D
请根据装置图回答下列问题:
(1)从氯化钾溶液中得到氯化钾固体选择装置________(填代表装置图的字母,下同);除去自来水中的Cl-等杂质得到蒸馏水,选择装置________。
(2)从碘水中分离出I2,选择装置________,该分离方法的名称为________。
(3)装置A中①的名称是________,冷凝水流动的方向是_________________________________________________________________。
(4)在用装置B进行操作时,为使液体顺利滴下,应进行的具体操作是_________________________________________________________________。
分液时要注意及时________,防止上层液体流下。分液后漏斗内剩余的液体从分液漏斗的________(填“上口”或“下口”)倒入烧杯。
查看答案和解析>>
科目: 来源: 题型:
【题目】N2O5是一种新型硝化剂,其性质和制备受到人们的关注。
(1)一定温度下,在恒容密闭容器中N2O5可发生下列反应:N2O5(g)![]() 4NO2(g)+O2(g);△H>0
4NO2(g)+O2(g);△H>0
①如表为反应在T1 温度下的部分实验数据:
t/s | 0 | 500 | 1000 |
c(N2O5)/mol·L-1 | 5.00 | 3.52 | 2.48 |
则500s内N2O5的分解速率为____________________。
②在T 2温度下,反应1000s时测得NO2的浓度为4.98 mol·L-1,则T2________T1( 填>、<或=)。
(2)现以H2、O2、熔融Na2CO3组成的燃料电池采用电解法制备N2O5,装置如图所示,其中Y为CO2。
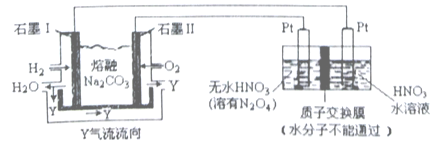
写出石墨Ⅰ电极上发生反应的电极反应式_____________________。N2O5 在电解池的_____________区生成(填“阳极”或“阴极”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ.如下图所示是实验中常用的几种仪器:
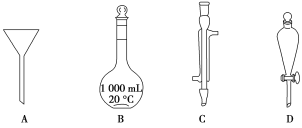
写出各字母所代表的仪器的名称:A________;B________;C________;D________。
Ⅱ.实验室要配制500 mL 0.2 mol/L NaOH溶液,请回答下列问题:
(1)配制过程中不需要使用的化学仪器有________(填字母)。
A.烧杯
B.500 mL容量瓶
C.漏斗
D.胶头滴管
E.玻璃棒
(2)用托盘天平称取氢氧化钠,其质量为________ g。
(3)下列主要操作步骤的正确顺序是________(填序号)。
①称取一定质量的氢氧化钠,放入烧杯中,用适量蒸馏水溶解;
②加水至液面离容量瓶瓶颈刻度线下1~2 cm时,改用胶头滴管滴加蒸馏水至凹液面与刻度线相切;
③待冷却至室温后,将溶液转移到500 mL容量瓶中;
④盖好瓶塞,反复上下颠倒,摇匀;
⑤用少量蒸馏水洗涤烧杯内壁和玻璃棒2~3次,洗涤液转移到容量瓶中。
(4)如果实验过程中缺少步骤⑤,会使配制出的NaOH溶液浓度________(填“偏高”“偏低”或“不变”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】现有21.6 g由CO和CO2组成的混合气体,在标准状况下其体积为13.44 L。回答下列问题:
(1)该混合气体的平均摩尔质量为________。
(2)混合气体中碳原子的质量为________。
(3)将混合气体依次通过如图所示装置,最后收集在气球中(实验在标准状况下测定)。
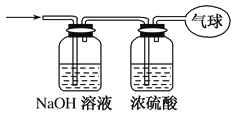
①气球中收集到的气体的摩尔质量为________。
②气球中收集到的气体中,电子总数为________(用NA表示阿伏加德罗常数的值)。
③气球的体积为________L。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)用0.lmol·L-1NaOH溶液分别滴定体积均为20.00mL、浓度均为0.1mol·L-1的盐酸和醋酸溶液,得到滴定过程中溶液pH随加入NaOH溶液体积而变化的两条滴定曲线。
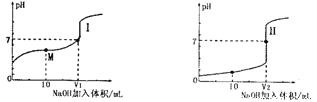
①滴定醋酸的曲线是__________(填“I”或“Ⅱ”)。
②V1和V2的关系:V1______V2(填“>”、“=”或“<”)
③M点对应的溶液中,各离子的物质的量浓度由大到小的顺序是_______________。
(2)为了研究沉淀溶解平衡和沉淀转化,某同学查阅资料并设计如下实验。资料:AgSCN是白色沉淀
操作步骤 | 现象 |
步骤1:向2mL0.005mol·L-1AgNO3溶液中 加入2mL0.005mol·L-1KSCN溶液,静置 | 出现白色沉淀 |
步骤2:取lmL上层清液于试管中,滴加1 滴2 mol·L-1Fe(NO3)3溶液 | 溶液变红色 |
步骤3:向步骤2的溶液中,继续加入5滴3mol·L-1 AgNO3溶液 | 出现白色沉淀,溶液红色变浅 |
步骤4:向步骤1余下的浊液中加入5滴3 mol·L-1 KI溶液 | 出现黄色沉淀 |
①写出步骤2中溶液变红色的离子方程式______________________。
②用化学平衡原理解释步骤3的实验现象______________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】既能与酸(H+)反应,又能与碱(OH-)反应的化合物是( )
①MgO②Al(OH)3③NaHSO4④NaHCO3⑤CH3COONH4⑥Al
A.②④B.②③④C.②④⑤D.②④⑤⑥
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ.根据下列各题中所给出的数据,可分别求出其溶液的“溶质质量分数”或溶液的“物质的量浓度”,试判断并求解。
(1)已知某氢氧化钠溶液V L中含有N个氢氧根离子,可求出此溶液的________ 是________。
(2)已知某氢氧化钠溶液中Na+与H2O的个数之比为1∶a,则可求出此溶液的________为________。
Ⅱ.常温下,10.0 mL 1.0 mol·L-1的H2SO4(aq),加水稀释到500 mL,所得H2SO4(aq)的浓度为________mol·L-1;蒸发浓缩,使溶液的体积为2.40 mL,所得H2SO4(aq)的浓度为________mol·L-1。
Ⅲ.已知标准状况下1体积水能溶解500体积的氯化氢,则可求出标准状况下氯化氢饱和溶液中溶质的质量分数为________。
查看答案和解析>>
科目: 来源: 题型:
【题目】在一定温度下的某容积可变的密闭容器中,建立下列化学平衡:C(s)+H2O(g)![]() CO(g)+H2(g)。可认定上述可逆反应在一定条件下已达到化学平衡状态的是
CO(g)+H2(g)。可认定上述可逆反应在一定条件下已达到化学平衡状态的是
A. 体系的压强不再发生变化
B. 2v正(CO)=v逆(H2O)
C. 生成n molCO的同时生成n mol H2
D. 1 mol H-H键断裂的同时断裂2 mol H-O键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com