
科目: 来源: 题型:
【题目】下列各组中的离子,能在溶液中大量共存的是( )
A.Fe3+、Na+、Cl﹣、OH﹣
B.Fe3+、Cl﹣、K+、Ca2+
C.Cl﹣、Ca2+、Mg2+、CO32﹣
D.Ba2+、K+、CO32﹣、Cl﹣
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)今有反应2H2+O2===2H2O,要构成燃料电池,则负极通入的应是________,正极通入的应是 ________,电极反应式分别为负极:__________________________、正极:________________。
(2)如把KOH改为稀H2SO4作电解液,则电极反应式分别为负极:__________、正极:______。
(3)如把H2改为甲烷,KOH溶液作电解液,则负极反应式为:______________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】依据氧化还原反应:2Ag+(aq)+Cu(s)=Cu2+(aq)+2Ag(s)设计的原电池如图所示。请回答下列问题:
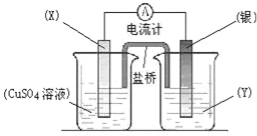
(1)电极X的材料是 (化学式);电解质溶液Y是 ;
(2)银电极为电池的 极,发生的电极反应为 ;X电极上发生的电极反应为 ;
(3)外电路中的电子是从 电极流向 电极。
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室里需要纯净的NaCl溶液,但现在只有混有Na2SO4、NH4HCO3的NaCl。某学生设计了如图所示方案提取纯净的NaCl溶液。
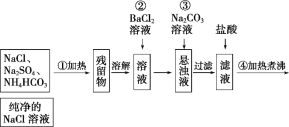
(已知:NH4HCO3![]() NH3↑+CO2↑+H2O)
NH3↑+CO2↑+H2O)
如果此方案正确,回答下列问题:
(1)操作①可选择的主要仪器是____________、____________。
(2)操作②不用硝酸钡溶液,其理由是__________________________________________。
(3)进行操作②后,如何判断SO42 已除尽,方法是_________________________。
(4)操作③的目的是________________。
(5)操作④的目的是__________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:25℃时,Kb(NH3·H2O)=1.8×10-5,该温度下,用0.100mol·L-1的氨水滴定10.00mL0.100mol·L-1的一元酸HA的溶液,滴定过程中加入氨水的体积(V)与溶液中lg![]() 的关系如右图所示。下列说法不正确的是
的关系如右图所示。下列说法不正确的是
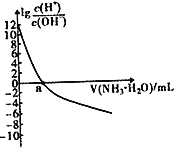
A. a=10 B. HA为强酸
C. 25℃时,NH4+的水解平衡常数为![]() ×10-9 D. 当滴入氨水的体积V=20mL时,溶液中存在c(NH4+)>c(A-)
×10-9 D. 当滴入氨水的体积V=20mL时,溶液中存在c(NH4+)>c(A-)
查看答案和解析>>
科目: 来源: 题型:
【题目】依据元素周期表和周期律的相关知识,下列说法正确的是( )
A.短周期元素中,原子最外层只有一个或两个电子的元素一定是金属元素
B.I属于副族元素
C.H2S的稳定性比H2O的稳定性强
D.Na、Mg、Al与冷水反应速率逐渐减弱
查看答案和解析>>
科目: 来源: 题型:
【题目】美国海军海底战事中心与麻省理工大学共同研制成功了用于潜航器的镁过氧化氢燃料电池系统。其工作原理如图所示。以下说法中错误的是( )

A.电池的负极反应为:Mg-2e-===Mg2+
B.电池工作时,H+向负极移动
C.电池工作一段时间后,溶液的pH增大
D.电池总反应式是:Mg+H2O2+2H+===Mg2++2H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】科学家从某中草药提取的有机物结构如下图所示。下列说法正确的是
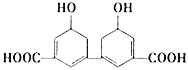
A. 分子式为C14H10O6
B. 环上氢原子被取代,所得一氯代物有3种
C. 1mol该有机物与足量NaOH溶液反应最多消耗4mol NaOH
D. 该有机物的熔点可能比同碳原子的烃分子熔点高
查看答案和解析>>
科目: 来源: 题型:
【题目】某校“研究性学习小组”欲完成反应2HCl+2Ag===2AgCl+H2↑而设计了下列四个实验,你认为可行的是( )

A. A B. B C. C D. D
查看答案和解析>>
科目: 来源: 题型:
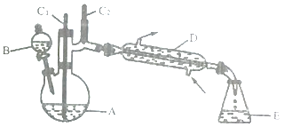
【题目】实验室可利用环己醇的氧化反应制备环己酮,反应原理和实验装置(部分夹持装置略去)如下:
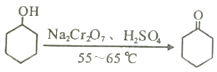
有关物质的物理性质见下表。
物质 | 沸点(℃) | 密度(g·cm-3,20℃) | 溶解性 |
环己醇 | 161.1(97.8)* | 0.96 | 能溶于水和醚 |
环己酮 | 155.6(95.0)* | 0.95 | 微溶于水,能溶于醚 |
水 | 100.0 | 1.0 |
*括号中的数据表示该有机物与水形成的具有固定组成的混合物的沸点。
实验中通过装置B将酸性Na2Cr2O7溶液加到盛有10mL环己醇的A中,在55~60℃进行反应。反应完成后,加入适量水,蒸馏,收集95~100℃的馏分,得到主要含环己酮粗品和水的混合物。
(1)装置D的的名称是为__________________。
(2)酸性Na2Cr207溶液氧化环己醇反应的△H<0,反应剧烈将导致体系温度迅速上升,副反应增多。
①如何滴加酸性Na2Cr2O7溶液__________________________________;
②蒸馏不能分离环己酮和水的原因是_____________________________________。
(3)环己酮的提纯需要经过以下一系列的操作:
a. 蒸馏、除去乙醚后,收集151~156℃馏分
b. 水层用乙醚(乙醚沸点34.6℃,易燃烧)萃取,萃取液并入有机层
c. 过滤
d. 往液体中加入NaCl固体至饱和,静置,分液
e. 加入无水MgSO4固体,除去有机物中少量的水
① 上述提纯步骤的正确顺序是______________________________;
② b中水层用乙醚萃取的目的是______________________________________;
③ 上述操作c、d中使用的玻璃仪器除烧杯、锥形瓶、玻璃棒外,还需要的玻璃仪器有_____________,操作d中,加入NaCl固体的作用是______________________________。
(4)恢复至室温时,分离得到纯产品体积为6mL,则环己酮的产率为______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com